El menisco medial presenta un potencial de revascularización en gran parte de su superficie
Medial meniscus presents revascularization potential in most of its surface
Resumen:
El objetivo del presente estudio es 1) saber si la vascularización del menisco difiere en función de las diferentes regiones del menisco (definidas en la clasificación de Smigielsky y cols.) y 2) comprobar la potencialidad del menisco para generar neovascularización.
Material y métodos: cuatro meniscos obtenidos de pacientes intervenidos de una prótesis total de rodilla (PTR). Se realizaron cortes en las diferentes zonas meniscales y se realizó un estudio con microscopía electrónica e inmunohistoquímico (CD34, CD31, f VIII, D2-40, S100, actina específica de músculo).
Resultados: no se detectaron vasos linfáticos con D2.40. Los vasos se detectaron mediante FcVIII, CD31 y CD34. Estos vasos se encontraron en la región denominada roja. Sin embargo, encontramos CD34 (sugestivos de células progenitoras endoteliales) más allá de la región vascularizada. La microscopía electrónica demostró que las fibras de colágeno seguían un nivel de densidad, empaquetamiento y rangos de diámetro normales.
Conclusiones: los resultados sugieren que la región avascular del menisco presenta potencialidad reparadora incluso en edades avanzadas. Futuros estudios deberían centrarse en diferenciar correctamente estas células e investigar su funcionalidad.
Abstract:
The main objective of this study was 1) to know whether meniscal vascularization is different depending on the different meniscal regions (described by Smigielsky et al.), and 2) to check the meniscus potentiality to generate neo-vascularization.
Methods: four fresh meniscus were obtained from patients underwent a total knee arthroplasty. Different cuts performed in the different meniscal regions were assessed by electron microscopy. An immunohistochemistry study (CD34, CD31, factor VIII, D2-40, S100, muscle specific actin) was also performed for each sample.
Results: no lymphatic vessels were observed with D2.40. Blood vessels were observed with FcVIII, CD31 and CD34. These vessels were observed in the red zone. However, CD34 (also segregated by progenitor endothelial cells) were observed beyond the vascularized area. Electron microscopy showed that collagen fibres showed normal density, packing and diameter ranges suggesting a normal distribution.
Conclusions: results suggested the meniscal avascular region have restoration potential even in advanced ages. Further studies might be planed to properly investigate these cells and its potentiality.
Introducción
El menisco es un fibrocartílago articular compuesto principalmente por fibras de colágeno de tipo I y agua. Entre sus principales funciones destacan la absorción de fuerzas y transmisión de carga, la lubricación y nutrición articular y una contribución a la estabilidad y congruencia de la rodilla. Todas estas funciones tienen como objeto final proteger al cartílago articular(1,2).
La mayor parte del menisco está vascularizado en la etapa prenatal. Tras nacer, este aporte vascular retrocede progresivamente hasta adquirir el patrón vascular definitivo, que se puede observar durante la edad adulta, sobre los 10 años de edad(3). La vascularización meniscal entra por dos vías: la primera, a través de la cubierta sinovial que, de forma irregular, se extiende por las superficies femoral y tibial de los meniscos; la segunda vía, y principal, a través del muro meniscal en sus diferentes inserciones capsulares. La penetración de estos vasos alcanza entre el 10% y el 30% del ancho del menisco. La vascularización que aporta la sinovial es especialmente importante a nivel de las raíces meniscales. Dicha sinovial tiene poca relevancia en el resto del menisco.
En las últimas décadas, el tratamiento de las lesiones meniscales ha tendido a ser más conservador, primando la reparación sobre la escisión del tejido lesionado. Sin embargo, la reparación está condicionada por la precaria vascularización que exhibe el tejido meniscal, que condiciona la actitud del cirujano cuando la lesión se sitúa en las zonas menos vascularizadas, también llamadas blancas. Esto es debido a que el pronóstico de las reparaciones meniscales en la zona periférica, vascular o roja, es mejor que el de aquellas realizadas en las zonas más centrales(4,5). Por otra parte, es conocido que las reparaciones meniscales realizadas al tiempo de una reconstrucción del ligamento cruzado anterior tienen también mejor pronóstico. Seguramente, esto es debido a la aparición de diversos factores favorecedores de la reparación que se liberan al realizar los túneles óseos(6,7).
Aunque la anatomía del menisco es bien conocida desde hace muchos años, recientemente, Smigielsky y cols.(8) han clasificado dicha anatomía del menisco medial en cinco zonas, desde la inserción anterior hasta la raíz posterior, en función del tipo de anclaje capsular. Teniendo en cuenta que la vascularización meniscal se produce a través de estas uniones meniscocapsulares, se nos plantea el interrogante de si esta vascularización (y secundariamente la capacidad intrínseca de reparación meniscal) podría variar en función de las diferentes zonas meniscales descritas.
El objetivo del presente estudio fue 1) saber si la vascularización del menisco difiere en función de las diferentes regiones del menisco (definidas en la clasificación de Smigielsky y cols.) y 2) comprobar la potencialidad del menisco para generar neovascularización.
Asumimos que no se encontrarían cambios significativos en las distintas zonas y que la capacidad de regenerar neovascularización sería nula.
Material y métodos
Se estudiaron 4 meniscos internos macroscópicamente sanos de pacientes programados para artroplastia total de rodilla en nuestra institución. Los casos fueron minuciosamente seleccionados entre pacientes afectos de genu valgo, sin pinzamiento articular en compartimento medial ni en la proyección de Rosenberg, ni en la telemetría en carga. Se excluyeron aquellos pacientes que presentaban signos de condrocalcinosis, estaban afectos de enfermedades reumáticas o tenían algún antecedente quirúrgico en la rodilla intervenida. Si durante la cirugía el aspecto macroscópico del tejido no se considerara adecuado, los meniscos también eran excluidos del estudio.
Los meniscos eran preservados junto a sus inserciones capsulares e inmediatamente remitidos al departamento de anatomía patológica, envueltos en una gasa humedecida con suero fisiológico a 4 °C. Previamente, se habían marcado las diferentes zonas del menisco(8) mediante un rotulador de tinta indeleble.
Estudio anatomopatológico
Una vez en el departamento de patología, se obtenían fotos macroscópicas de las piezas. A continuación, los meniscos se seccionaron en cortes radiales con cuchillas nuevas desechables y, de los fragmentos resultantes, se extrajeron secciones de 1 mm de grosor máximo. Estas últimas se fijaron en glutaraldehído al 2,5% en tampón cacodilato sódico 0,2 M, a un pH de 7,4 durante 2 horas. Los fragmentos grandes se fijaron en formol neutro tamponado durante 24 horas.
Las muestras fijadas en formol se incluyeron en parafina y fueron la base del estudio de microscopía óptica. Los pequeños fragmentos fijados en glutaraldehído se fijaron en tetróxido de osmio y se incluyeron en resina epoxi, constituyendo la base del estudio de microscopía electrónica.
En el estudio de microscopía óptica, se efectuaron secciones de 5 µm de los bloques de parafina que se tiñeron con las siguientes técnicas:
- Hematoxilina y eosina.
- Tricrómico de Masson, para estudio de la disposición de colágeno.
- Van Gieson, para fibras elásticas.
- PAS (ácido periódico-Schiff), para sustancia amorfa extracelular.
- Alcian Blue pH = 2,1, para sustancia amorfa extracelular.
- Estudio inmunohistoquímico con los siguientes marcadores para identificar las siguientes estructuras:
- CD34, endotelio y fibroblastos primitivos.
- CD31, endotelio e histiocitos.
- Factor VIII, vasos sanguíneos.
- D2-40, endotelio linfático.
- S100, para la identificación de condrocitos.
- Actina específica de músculo, para miofibroblastos.
- Actina específica de músculo liso, para miofibroblastos.
En el estudio de microscopía electrónica se efectuaron cortes de 150 nm que se estudiaron con microscopía electrónica de transmisión (FEI CM100 Phillips).
Estadística
Las variables continuas serán presentadas como media y rango. Las variables categóricas serán presentadas como porcentajes. El estudio estadístico será realizado usando el sistema SPSS 12 (SPSS Inc., Chicago, Illinois, EE.UU.).
Resultados
Los 4 meniscos mediales estudiados fueron obtenidos de 3 mujeres y un varón, con una edad media de 62,2 años (rango 49-77). Las medidas de los meniscos fueron las siguientes:
- Caso 1: 80 × 16 × 10 mm
- Caso 2: 75 × 18 × 15 mm
- Caso 3: 62 × 13 × 7 mm
- Caso 4: 80 × 12 × 10 mm
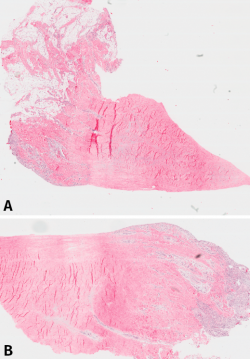
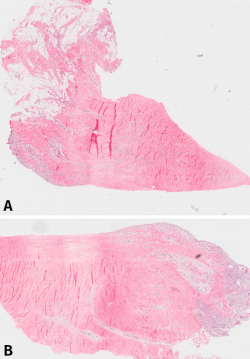
Histológicamente, todos eran meniscos sanos, sin signos inflamatorios, ni tejido de granulación, cambios sinoviales o cualquier otra anormalidad. No se detectaron signos degenerativos en la textura del componente fibrilar ni en la proporción de la mucina intersticial detectada con la tinción de Alcian Blue. Es interesante remarcar que la reacción ante esta tinción era bastante intensa, sugiriendo que el contenido de mucina intersticial del menisco era mayor de lo inicialmente esperado. La tinción con tricrómico reveló una regular distribución del entrelazado de las fibras de colágeno (Figura 1).
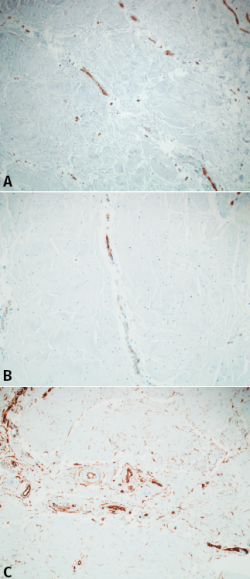
No se detectaron vasos linfáticos con D2.40. Los vasos sanguíneos fueron identificados mediante el factor VIII, CD31 y CD34. La mayoría de estos se originaban desde la parte más periférica en dirección centrípeta. Además, la mayoría de estos vasos se originaban directamente o en íntima relación con el tejido sinovial y la cápsula articular. Aproximadamente, la longitud de los vasos abarcaba entre un tercio y un cuarto de la longitud del menisco. La mayoría de estos vasos estaban rodeados por una capa de tejido conectivo no adherido en su totalidad. El denso tejido conectivo alrededor no contenía condrocitos. La serie de diferentes reconstrucciones de las secciones consecutivas revelaron que las diferentes zonas descritas por Smigielsky y cols.(8) no seguían un patrón específico de vascularización cuando se relacionaron con esta clasificación. Más bien seguían una sucesión de vasos y zonas más escleróticas. Llama la atención que, mientras el factor VIII y el marcador CD31 seguían una patrón similar coincidiendo con la zona vascularizada del menisco, el marcador CD34 seguía un patrón diferente. Además, los fibroblastos primitivos que rodean los vasos sanguíneos se extendían más allá de la zona vascularizada, formando una malla en el tejido adyacente no vascularizado (Figura 2).
figura2.png
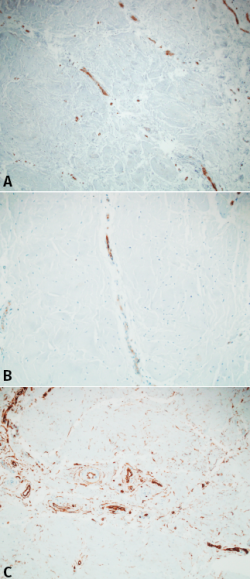
Figura 2. A: inmunohistoquímica para factor VIII. Nótese que los vasos interseptales se prolongan una determinada longitud del fibrocartílago; B: inmunohistoquímica para CD31 que muestra un patrón muy parecido al factor VIII; C: inmunohisquímica para CD34. Se puede apreciar un patrón diferente a los anteriores, con fibroblastos primitivos que se extienden más allá de los vasos hasta alcanzar tejido meniscal no vascularizado.
La proporción de condrocitos fue relativamente baja y no estaban mezclados con fibroblastos. Sin embargo, solo un 10% aproximadamente de la tinción para condrocitos fue positiva para el anticuerpo S100. Los fibroblastos sinoviales, así como los fibroblastos en el tercio periférico del menisco, tendían a ser intensamente positivos para los anticuerpos CD34, sugiriendo un fenotipo bastante primitivo. Ambos anticuerpos para la actina fueron negativos en los fibroblastos, indicando que no había diferenciación miofibroblástica. Con el anticuerpo Ki67, no se detectaron células positivas en el fibrocartílago, indicando que la mayoría de estas estaban en la fase G0 o en el ciclo celular.
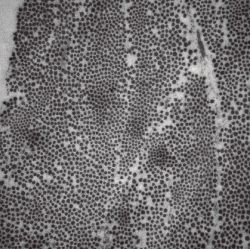
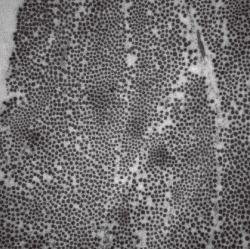
Al realizar la microscopía electrónica, se observó que la densidad, empaquetamiento y rangos de diámetros de las fibras de colágeno en los cortes transversales de los diferentes cortes en los 4 meniscos estudiados seguían una distribución normal (Figura 3).
Discusión
El principal hallazgo de este trabajo es que el tejido meniscal estudiado presenta células con potencialidad de neovascularización en gran parte de su extensión. Un segundo hallazgo es que la vascularización del menisco medial no depende de la zona del menisco en la que nos hallemos, definida por la clasificación de Smigielsky y cols.
La limitada capacidad de cicatrización del tejido meniscal, debido a su pobre vascularización, y el uso de técnicas destinadas a mejorarla han suscitado interés en la comunidad científica. Forriol y cols.(9) estudiaron recientemente, en un modelo animal, el efecto de diferentes inductores de la síntesis de matriz extracelular en la reparación meniscal. Pudieron observar que el BMP-7 (bone morphogenetic protein-7) y los condrocitos autólogos, al asociarse a la trefinación y las técnicas de sutura meniscal, mejoraban el proceso de cicatrización en la zona avascular del menisco. Sin embargo, este efecto no se produjo cuando se utilizó VEGF (vascular endothelial growth factor). Di Giancamillo y cols.(10) estudiaron la caracterización vascular del menisco en diferentes estadios de maduración (neonatal, joven y adulto) en un modelo experimental porcino. Los autores observaron cómo la expresión de VEGF y la de VE-Cad (vascular endothelial cadherin) presentaban un patrón similar con una mayor presencia en la parte vascularizada del menisco. Por otro lado, los meniscos jóvenes tenían una mayor expresión de anti-angiogenic marker endostatin (ENDO) en comparación con el menisco neonatal y adulto. Todos estos datos sugieren que los diferentes reguladores de la angiogénesis varían en función del proceso madurativo del menisco. Sin embargo, otros estudios han fracasado en el intento de demostrar la supuesta capacidad reparadora del VEGF en la porción avascular del menisco(11,12,13,14,15,16).
Declercq y cols.(17) estudiaron la contribución de las células CD34+ a la homeostasis del tejido meniscal en respuesta a una ruptura. Los autores observaron cómo estas células responden a una lesión diferenciándose en células maduras que segregan matriz extracelular. Sin embargo, en su estudio no se consiguió identificar este tipo celular en meniscos obtenidos de rodillas artrósicas. Contrariamente, en el presente estudio, realizado también con meniscos obtenidos de rodillas añosas, la inmunohistoquímica ha demostrado la presencia de células progenitoras CD34+ en la región avascular del menisco, con capacidad de diferenciación. Verdonk y cols.(18), en un estudio realizado en humanos, 24 horas posmórtem, también encontraron células CD34+ y CD31– en la capa superficial de la zona avascular del menisco. Sin embargo, no consiguieron encontrar células CD34+ en capas profundas. Habría que aclarar que la expresión de CD34 se considera un signo de lo que se ha dado en llamar stemness, es decir, un reflejo de un cierto grado de parentesco con una célula madre. Así se ha demostrado en células hematopoyéticas, germinales y células del tejido conectivo. Pero en ningún caso se hace referencia a migración embriológica ni en la vida adulta, sino que sería el reflejo de que en el menisco hay una población de células de fenotipo óptico y ultraestructural fibroblástico que conservan un cierto potencial de desdiferenciarse, proliferar y reorganizar el tejido donde se encuentran. El hecho además de que el CD34 sea un marcador endotelial nos hace deducir que estamos ante una proliferación vascular, ya sea fisiológica o reparativa.
Este estudio tiene algunas limitaciones, como son el reducido número de meniscos estudiados, aunque la uniformidad de los hallazgos hace pensar que este es el patrón habitual. Una segunda limitación es la edad media avanzada de los meniscos estudiados. Esta sería una clara limitación para el primer objetivo, puesto que solo se puede definir la vascularización existente en este segmento de edad. Sin embargo, el hecho de haber hallado células CD34+ en la región avascular del menisco en estas edades sugiere que estas células están siempre presentes.
En conclusión, los resultados sugieren que la región avascular del menisco presenta potencialidad reparadora incluso en edades avanzadas. Futuros estudios deberían centrarse en diferenciar correctamente estas células e investigar su funcionalidad.
Figuras
Figura 1. A: vista panorámica del menisco número 1 (tinción hematoxilina-eosina); B: vista panorámica del mismo menisco, donde puede observarse la penetración de los vasos en el tejido meniscal desde la periferia.
Figura 2. A: inmunohistoquímica para factor VIII. Nótese que los vasos interseptales se prolongan una determinada longitud del fibrocartílago; B: inmunohistoquímica para CD31 que muestra un patrón muy parecido al factor VIII; C: inmunohisquímica para CD34. Se puede apreciar un patrón diferente a los anteriores, con fibroblastos primitivos que se extienden más allá de los vasos hasta alcanzar tejido meniscal no vascularizado.
Información del artículo
Cita bibliográfica
Autores
Raúl Torres Claramunt
Servicio de Ortopedia y Traumatología. Parc de Salut Mar. Barcelona
IMIM. Hospital del Mar Medical Research Institute. Barcelona
ICATME-Dexeus-Quirón. Barcelona
Pedro Hinarejos Gómez
Departamento de Cirugía Ortopédica y Traumatología. Hospital del Mar. Universitat Autònoma de Barcelona
IMIM. Hospital del Mar Medical Research Institute. Barcelona
Juan Francisco Sanchez Soler
Departamento de Cirugía Ortopédica y Traumatología. Hospital del Mar. Universitat Autònoma de Barcelona
IMIM. Hospital del Mar Medical Research Institute. Barcelona
Joan Leal Blanquet
Unidad de Rodilla. IMAS. Hospitales del Mar y de l’Esperança. Barcelona
Subdirector de REACA
Josep Lloreta
Servicio de Anatomía Patológica. IMAS-Hospitales del Mar y de la Esperança. Barcelona
Joan Carles Monllau
ICATME. Hospital Universitari Quirón-Dexeus. Barcelona, España
Universitat Autònoma de Barcelona, Bellaterra, Barcelona, España
Cirurgía Ortopédica y Traumatología, Hospital del Mar-Parc de Salut Mar, Barcelona, España
IMIM. Hospital del Mar Medical Research Institute. Barcelona
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Financiación. Este trabajo ha sido financiado con la ayuda de una beca de investigación de la AEA en 2016.
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Bessete GC. The meniscus. Orthopaedics 1992;15:35-42.
-
2Verdonk R, Madry H, Shabshin N, Dirisamer F, Peretti GM, Pujol N, et al. The role of meniscal tissue in joint protection in early osteoarthritis. Knee Surg Sports Traumatol Arthrosc. 2016;24(6):1763-74.
-
3Arnoczky SP, Warren RF. Microvasculature of the human meniscus. Am J Sports Med. 1982;10(2):90-5.
-
4De Albornoz PM, Forriol F. The meniscal healing process. Muscles Ligaments Tendons J. 2012;2(1):10-8.
-
5Weiss CB, Lundberg M, Hamberg P, DeHaven KE, Gillquist J. Non-operative treatment of meniscal tears. J Bone Joint Surg Am. 1989;71:811-22.
-
6De Girolamo L, Galliera E, Volpi P, Denti M, Dogliotti G, Quaglia A, et al. Why menisci show higher healing rate when repaired during ACL reconstruction? Growth factors can be the explanation. Knee Surg Sports Traumatol Arthrosc. 2015;23(1):90-6.
-
7Yagashita K, Muneta T, Ogiuchi T, Sekiya I, Shinomiya K. Healing potential of meniscal tears without repair in knees with anterior cruciate ligament reconstruction. Am J Sports Med. 2004;32:1953-61.
-
8Smigielski R, Becker R, Zdanowicz U, Ciszek B. Medial meniscus anatomy-from basic science to treatment. Knee Surg Sports Traumatol Arthrosc. 2015;23(1):8-14.
-
9Forriol F, Longo UG, Duart J, Ripalda P, Vaquero J, Loppini M, et al. VEGF, BMP-7, Matrigel (TM), hyaluronic acid, in vitro cultured chondrocytes and trephination for healing of the avascular portion of the meniscus. An experimental study in sheep. Curr Stem Cell Res Ther. 2014;10(1):69-76.
-
10Di Giancamillo A, Deponti D, Modina S, Tessaro I, Domeneghini C, Peretti GM. Age-related modulation of angiogenesis-regulating factors in swine meniscus. J Cell Mol Med. 2017;21(11):3066-75.
-
11Esparza R, Gortazar AR, Forriol F. Cell study of the three areas of the meniscus: effect of growth factors in an experimental model in sheep. J Orthop Res. 2012;30:1647-51.
-
12Iban MAR, Melero NC, Martinez-Botas J, Ortiz A, Heredia JD. Growth factor expression after lesion creation in the avascular zone of the meniscus: a quantitative PCR study in rabbits. Arthroscopy. 2014;30:1131-8.
-
13Becker R, Pufe T, Kulow S, Giessmann N, Neumann W, Mentlein R, et al. Expression of vascular endothelial growth factor during healing of the meniscus in a rabbit model. J Bone Joint Surgery Br. 2004;86:1082-7.
-
14Petersen W, Pufe T, Starke C, Fuchs T, Kopf S, Raschke M, et al. Locally applied angiogenic factors – a new therapeutic tool for meniscal repair. Ann Anat. 2005;187:509-19.
-
15Kopf S, Birkenfeld F, Becker R, Petersen W, Stärke C, Wruck CJ, et al. Local treatment of meniscal lesions with vascular endothelial growth factor. J Bone Joint Surg Am. 2010;92:2682-91.
-
16Kawanishi Y, Nakasa T, Shoji T, Hamanishi M, Shimizu R, Kamei N, et al. Intraarticular injection of synthetic microRNA-210 accelerates avascular meniscal healing in rat medial meniscal injured model. Arthritis Res Ther. 2014;16:488.
-
17Declercq HA, Forsyth RG, Verbruggen A, Verdonk R, Cornelissen MJ, Verdonk PC. CD34 and SMA expression of superficial zone cells in the normal and pathological human meniscus. J Orthop Res. 2012;30(5):800-8.
-
18Verdonk PC, Forsyth RB, Wang J, Almqvist KF, Verdonk R, Veys EM, et al. Characterisation of human knee meniscus cell phenotype. Osteoarthritis Cartilage. 2005;13(7):548-60.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Biomecánica y reconstrucción anatómica del ligamento anterolateral de la rodilla
- El menisco medial presenta un potencial de revascularización en gran parte de su superficie
- Reconstrucción del LCA con autoinjerto del tendón cuadricipital
- Importancia de los defectos óseos en deportistas de contacto con inestabilidad de hombro
- Estudio de la fatiga muscular tras tenodesis de la porción larga del bíceps braquial
- Lipoma arborescente como causa de dolor articular de hombro y rodilla. Actualización bibliográfica y revisión de cinco casos
- Abordajes artroscópicos posteriores en cirugía de rodilla
- Inserción bífida de la porción larga del bíceps
- Inestabilidad de hombro: el dilema de cómo tratar el defecto óseo
- Inestabilidad de hombro: la técnica de <em>remplissage</em>
- Tendón poplíteo en el hiato poplíteo
- Reconocimiento a los revisores 2019
- El ligamento anterolateral de rodilla: ¿un hecho o un mito?
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.