Microfracturas o estimulación de la médula ósea (BMS): la evolución de la técnica
Microfractures or bone marrow stimulation (BMS): evolution of the technique
Resumen:
La microfractura es la técnica más utilizada en la reparación de las lesiones condrales focales de las articulaciones. En los últimos años, la técnica ha mejorado con la incorporación de la artroscopia, la mejora del instrumental utilizado y, últimamente, por participar de los adelantos de la ingeniería de tejidos. En las llamadas microfracturas plus, los nuevos biomateriales rellenan la lesión y retienen el sangrado permitiendo que se forme un coágulo, con todo el material biológico incorporado, que permite un proceso de reparación más biológico, con un mejor resultado estructural y, por lo tanto, con un tejido que soporta mejor las solicitaciones mecánicas y permite una mayor duración. Hacemos una revisión de la situación actual de algunas de estas técnicas.
Abstract:
Microfracture is the most widely used technique for repairing focal chondral lesions of the joints. In recent years, the procedure has been improved with the incorporation of arthroscopy, optimization of the instruments used and, lately, the introduction of advances in the field of tissue engineering. In the so-called microfracture plus method, novel biomaterials are used to fill the lesion and retain bleeding to thus form a clot with all the incorporated biomaterial component - resulting in a more biological repair process with improved structural outcomes, and affording a tissue better able to support the mechanical demands with increased durability. A review is made of the state of the art of some of these techniques.
Introducción
Las microfracturas son, en realidad, una evolución de la técnica original de Pridie desarrollada en los años cincuenta(1) y perfeccionada por Steadman en los ochenta(2). Con el paso del tiempo, esta técnica se ha ido haciendo cada vez más popular hasta convertirse en la referencia para la reparación del cartílago y el procedimiento con el que se comparan otras técnicas; con todas sus variantes, sigue siendo la técnica más utilizada para la reparación de las lesiones condrales focales(3).
Al ser el cartílago articular un tejido sin nervios y avascular en la mayoría de su estructura, no cuenta con la capacidad intrínseca para generar una respuesta adecuada para desencadenar los acontecimientos que se presentan cuando un tejido sufre una lesión que altera su estructura produciendo un sangrado local. Al realizar unas perforaciones en el hueso subcondral, se produce un sangrado activo proveniente de la médula ósea y de la microvascularización que perfora la placa subcondral, introduciéndose en la capa calcificada del cartílago. Este sangrado genera un coágulo llamado, por Steadman, “supercoágulo”, que se forma en un entorno que le es muy hostil desde el punto de vista mecánico y que hace que se pueda desprender fácilmente antes de cumplir con su función(4).
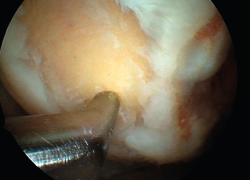
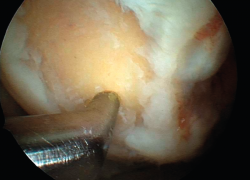
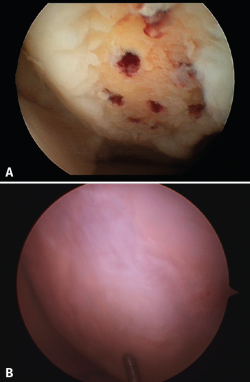
Sin embargo, la técnica de las microfracturas constituye una serie de técnicas que se agrupan dentro de la estimulación de la médula ósea (bone marrow stimulation –BMS–). Las técnicas basadas en la BMS han evolucionado con los años. Así, han pasado desde la simple abrasión, pasando por las perforaciones motorizadas de grueso calibre, las no motorizadas que utilizan los “picahielos” (Figura 1), de entre 1,5 y 2,5 mm de diámetro, hasta las que utilizan perforaciones de pequeño calibre, con profundidades de hasta 9 mm, mucho menos agresivas para la estructura ósea y medular, conocidas como “perforaciones subcondrales” o subchondral drilling.
Adicionalmente, junto con esta evolución técnica, se han ido agregando diversas estrategias para cubrir y proteger el coágulo sanguíneo, base del inicio del proceso de cicatrización, con el fin de mejorar sus resultados. Esto es lo que se conoce como “microfractura plus”, enhanced BMS o también augmented microfracture(5,6).
En este artículo desarrollaremos los fundamentos biológicos sobre los que se basan estos procedimientos y algunas de las tecnologías que utilizan y que basan su modo de acción en principios que hemos considerado fisiológicamente “elegantes”.
Fundamentos biológicos
Esta familia de técnicas tiene su fundamento en la biología, ya que la presencia del coágulo sanguíneo es indispensable para desencadenar el complejo proceso de cicatrización en cualquier tejido humano. El coágulo contiene todos los elementos necesarios para que, en sucesivas etapas, la cascada de eventos, como son la de la inducción de la respuesta inflamatoria reparadora, seguida de la modulación de esta y la aparición del nuevo tejido, por la maduración del tejido de granulación, se produzcan de una manera natural y concatenada para que aparezca, finalmente, el tejido cicatricial, que puede ser indistinguible del tejido original (cicatrización ad integrum) y al que podríamos llamar técnicamente “tejido regenerado”, o una cicatriz de calidad variable según se asemeje más o menos al tejido original, y entonces hablaremos de “tejido reparado”.
En la reparación del cartílago articular se obtiene, en la inmensa mayoría de los casos, un tejido cicatricial que variará en calidad según su hidratación y la presencia, la orientación y el porcentaje de colágeno de tipo 2, que es propio del cartílago articular, llamado también cartílago hialino. Cuando este tipo de colágeno no se encuentra o se haya en proporciones inferiores a lo usual, se habla entonces de un fibrocartílago. Preferimos hablar de cartílago con más o con menos “características hialinas”, ya que esta denominación se acerca más a lo que sucede en la vida real. Cuanto más hialino sea el cartílago obtenido, es decir, cuanto más estratificado esté el tejido, con presencia, en cantidad y localización adecuadas, de colágeno de tipo 2, con una hidratación adecuada, marcada por la presencia de glicosaminoglicanos (GAG), y con el espesor adecuado, los resultados serán mejores y cabrá esperar mayor duración en el tiempo. Por el contrario, cuanta más cantidad aparezca de colágeno de tipo 1 que de tipo 2, con un tejido no estratificado y excesivamente hidratado o con muy poca agua, estaremos en presencia de un tejido fibroso, fibrocartílago, con unas prestaciones biomecánicas inferiores, que no cumplirá con su doble función como superficie de deslizamiento y como distribuidor de las solicitaciones mecánicas, provocando un deterioro acelerado.
Al ser el cartílago articular un tejido aneural y avascular en la mayoría de su estructura (mas no en toda, como veremos más adelante), este no cuenta con la capacidad intrínseca para generar una respuesta adecuada para desencadenar los acontecimientos que se presentan cuando un tejido sufre una injuria que altera sustancialmente su integridad estructural, produciendo un sangrado local. Al realizar unas perforaciones en el hueso subcondral que comuniquen el medio articular con el espacio subcondral, se produce un sangrado activo proveniente de la médula ósea y de la microvascularización que perfora la placa subcondral y se introduce en la capa calcificada del cartílago. Este sangrado genera un coágulo, llamado por Steadman “supercoágulo”, que se forma en un entorno que le es muy hostil desde el punto de vista mecánico y que hace que se pueda desprender fácilmente antes de cumplir a cabalidad con su función.
El coágulo, el actor principal
El coágulo sanguíneo cumple varias funciones, todas ellas fundamentales, en el proceso de cicatrización de los tejidos. Sin embargo, cuando un tejido vascularizado sufre una lesión, la vascularización local se ve afectada por la rotura de los vasos. Esto inicia una cadena de eventos perfectamente coordinados. La coagulación es el primero de ellos, un mecanismo para detener lo más rápidamente la hemorragia que se produce y que, eventualmente, pone en riesgo la supervivencia del tejido.
El coágulo es una barrera física tridimensional, activa biológicamente, compuesta por fibrina y plaquetas. Las plaquetas cumplen con 2 funciones, una puramente hemostática, al apilarse en las paredes de los vasos rotos tratando de cerrar la brecha, y la otra secretora, al ser activadas, liberando inmediatamente los elementos contenidos en sus granulaciones “alfa”. Así es como se secretan diversas citocinas, por ejemplo, el PDGF (platelet derived growth factor) y el TGF-β (transforming growth factor beta), que servirán para inducir la respuesta inflamatoria. En una segunda etapa, otras sustancias similares, como son el VEGF (vascular endothelial growth factor) y el FGF (fibroblast growth factor), entre otras muchas, modulan la respuesta y el inicio de la actividad reparadora (cicatrización)(7).
Según el tejido, la cicatrización puede ser más o menos sofisticada, ir desde una cicatriz simple y fibrosa hasta una reparación estructurada que alcanza una regeneración ad integrum del tejido dañado, como ocurre en el tejido óseo.
Influencias desde el hueso subcondral
El hueso subcondral es, como su nombre indica, la zona subyacente al cartílago articular, más precisamente a la capa calcificada del cartílago, con la que forma una “unidad funcional” con el resto del cartílago(8). El hueso subcondral es el encargado de efectuar la transición biomecánica entre el cartílago propiamente dicho, cuya función es obtener la mínima fricción con el rozamiento y distribuir las solicitaciones mecánicas que lo atraviesan, para que estas fuerzas sean absorbidas por el hueso subcondral y transmitidas a su vez a las metáfisis y diáfisis del hueso.
La superficie de contacto entre cartílago y hueso no es plana, sino ondulada, brindando una mayor superficie de contacto y un efecto de interbloqueo muy efectivo.
Por otro lado, la región subcondral es vascularmente muy rica, posee una microvascularización arteriovenosa y algo de inervación; estas estructuras penetran por microcanales hasta alcanzar la capa calcificada del cartílago. Esto tiene sus implicaciones cuando se produce una lesión(9) y explica en parte por qué las lesiones condrales de espesor total (grado 4 de la International Cartilage Repair Society –ICRS– y de Outerbridge) tienen la posibilidad de generar una respuesta reparadora espontánea y, también, que los procedimientos de BMS, como ocurre con las microfracturas, obtengan buenos resultados, aunque no óptimos. Adicionalmente, explica la necesidad de hacer el curetaje de la capa calcificada del cartílago con estas técnicas, pues al removerla se provoca el sangrado(10).
Influencias de la sinovial
El proceso condrogénico provocado por la sinovial ha tenido menor atención que la que recibe el hueso subcondral. Sin embargo, las células mesenquimales procedentes de la membrana sinovial han mostrado tener un “tremendo potencial condrogénico”(11). Al compararlas con otras fuentes como la médula ósea o el tejido adiposo, se ha visto su mayor capacidad de contribuir con el proceso condrogénico(12). Esto no debe extrañar, pues es bien conocida la función de esta estructura en el mantenimiento de la homeostasis articular. La membrana sinovial está ricamente vascularizada e inervada, dos importantes factores para producir una respuesta inflamatoria reparadora. Por esta razón, cualquier implante que coloquemos sobre una lesión focal de cartílago debe tener la porosidad suficiente para permitir la penetración de células condrogénicas y sustancias bioactivas(13).
Microfracturas plus
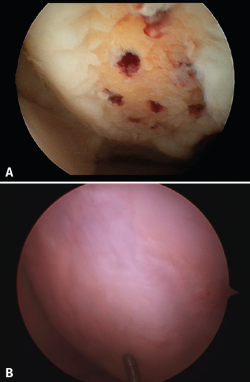
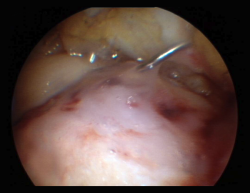
Los resultados obtenidos con las técnicas de microfractura muestran variaciones, dependiendo de los autores. Esto es debido a las diferentes características hialinas del regenerado cartilaginoso; en ocasiones es elevado el porcentaje de fibrocartílago (Figura 2), por una mayor presencia de colágeno de tipo 1 y ausencia de colágeno de tipo 2, además de la ausencia de un cartílago estratificado. El cartílago hialino cuenta con colágeno de tipo 1 en la superficie de deslizamiento, siendo el colágeno de tipo 2 el predominante en el resto del tejido, dispuesto de tal manera que se configuran 3 zonas básicas de estratificación. Estas características estructurales le confieren las especiales propiedades biomecánicas que le permiten una larga duración(13).
Los estudios experimentales con diversas técnicas de aumentación de las microfracturas, así como los estudios clínicos, demuestran, uniformemente, diversos grados de mejoría de la cantidad y la calidad (características hialinas) del nuevo tejido, lo que debería traducirse en una mayor duración de este, así como en unos mejores resultados clínicos(14).
Los fundamentos biológicos básicos son los mismos que se han mencionado para las microfracturas. Pero se añade la protección de la estructura responsable del coágulo sanguíneo, utilizando diversos biomateriales naturales (colágenos, alginatos, fibrinas, ácido hialurónico, hidroxiapatita, chitosán) y sintéticos (ácidos poliglicólico y poliláctico, en sus diversas variantes) implantados en diferentes presentaciones (matrices sólidas, membranas, geles). Con esto se ayuda al proceso de reparación.
Como señala Brittberg(15), uno de los padres de la tecnología del cultivo de condrocitos, para reparar tejidos dañados por medios biológicos siempre se requieren células. Lo que cambia es la forma de usarlas, que puede ser atrayéndolas hacia el sitio de la lesión por medio de “algo” que amplifique la respuesta fisiológica, lo que él denomina uso “intrínseco” de las células (en este caso, una “condroinducción in situ”), o efectuando cultivos de estas e implantándolas posteriormente, lo que denomina uso “extrínseco”. Por supuesto, ambas formas son válidas y habrá indicaciones en las cuales una pueda ser más apropiada que la otra, teniendo en cuenta aspectos como la edad, la actividad del paciente, la talla, la profundidad de la lesión o su localización. Pero sin olvidar la relación costo-beneficio y la experiencia del cirujano, aspectos todos ellos que deben ser sopesados a la hora de optar por una u otra opción disponible.
Este sustrato celular, que no es el objetivo de nuestra revisión, es llamado de diversas maneras, pero comúnmente conocido como “células madre” (mesenchymal stem cells –MSC–)(16), rebautizadas por Caplan(17), quien las describió inicialmente, a finales de los años ochenta, como medicinal signaling cells, por ajustarse mejor esta denominación a su naturaleza y acción. El grupo de Caplan llamaba a una reflexión sobre los desafíos que presentaba la diferenciación condrogénica de esta estirpe celular, sobre todo si pensábamos que estas por sí solas eran capaces de formar cartílago hialino(18). Como cirujanos ortopédicos, debemos favorecer y facilitar, con nuestras acciones, que este sistema funcione, pero en ningún caso intentar modificarlo, pues es ahí donde podemos encontrar mayores problemas.
Con las microfracturas plus, el objetivo es generar esta población celular y los demás componentes bioactivos que intervienen en el proceso de la condrogénesis, creando un entorno óptimo en el “órgano sinovial” (que es como debemos entender a las articulaciones sinoviales, con todo lo que esta denominación implica), para que el proceso se desarrolle de la mejor manera posible, contrarrestando los efectos negativos para este proceso provenientes del microambiente hostil que constituye una articulación.
Materiales utilizados
No pretendemos hacer una revisión exhaustiva de las diversas opciones de materiales y de algunos productos que se encuentran disponibles actualmente para aumentar la prestación de las microfracturas. La clave es comprender la racionalidad del modo de acción. La elección de una u otra tecnología depende del cirujano. Todas las tecnologías basadas en estos principios tienen algo que aportar cuando han sido concebidas basándose en los principios biológicos descritos y estos son utilizados adecuadamente. La clasificación que sigue a continuación es arbitraria.
Membranas AMIC
El acrónimo AMIC significa autologous matrix-induced chondrogenesis que, traducido, sería “condrogénesis inducida por matriz autóloga”. Inicialmente, se utilizó para designar únicamente la utilización de una matriz específica de 2 capas de origen porcino, compuesta de colágeno de tipo 1 y de tipo 3 (Chondro-Gide®, Geistlich Biomaterials AG, Wolhusen-Suiza)(19,20). De hecho, AMIC® es una marca registrada por Geistlich y teóricamente no debería ser empleada sino en los procedimientos en los que se utilice esta matriz. Sin embargo, su uso se ha extendido también a otras opciones y se habla de procedimientos “de tipo AMIC”. Incluso, se ha utilizado concomitantemente con la implantación de condrocitos autólogos, para sellar la lesión y contener los condrocitos en suspensión(21).
Como en todas las microfracturas plus, el implante escogido, en este caso la membrana, pretende proteger la integridad estructural y funcional del coágulo producto de la BMS y, si es posible, favorecer su acción. Para estabilizar la membrana, esta debe ser utilizada con pegamento de fibrina en los bordes en contacto con el cartílago circundante.
La revisión más reciente relacionada con esta técnica(22) analiza los resultados de 12 estudios de lesiones condrales focales en la rodilla, uno de ellos comparativo y aleatorizado, con 375 pacientes. Muestra resultados positivos en el mediano plazo hasta los 5 años, tanto en el aspecto clínico como en la estructura del nuevo tejido, con un 66% de los pacientes mostrando buena calidad de la reparación, medida con métodos semicuantitativos como el MOCART (magnetic resonance observation of cartilage repair tissue). Esta técnica también se ha utilizado en otras articulaciones distintas a la rodilla con resultados positivos.
Existen otras membranas en el mercado, como puede ser el Hyalofast® (Anika Therapeutics, Padova, Italia), hecho a partir de una base de éster del ácido hialurónico, con un uso extendido. Igualmente, implantes tridimensionales más sólidos, como puede ser el MaioRegen® (Finceramica, Faenza, Italia), hecho a base de colágeno de tipo 1 e hidroxiapatita en una estructura estratificada que sea útil también en la generación de tejido óseo, como en las lesiones con un componente osteocondral importante; asimismo, el Agili-C™ (CartiHeal Ltd., Ariel, Israel), manufacturado a partir de aragonita (carbonato de calcio derivado del coral marino). Actualmente, se encuentra en marcha en los Estados Unidos un estudio aleatorizado que compara este producto con el tratamiento estándar para ser presentado ante la Food and Drug Administration (FDA) con vistas a su aprobación.
Geles y similares
Se incluyen aquí el GelrinC® (Regentis Biomaterials, Akiva, Israel) basado en una mezcla de polietilenglicol diacrilato (PEG-DA) y fibrinógeno desnaturalizado, que reacciona con la exposición a la luz ultravioleta transformándose en un gel semisólido. Un estudio comparativo con microfractura sola se encuentra también en marcha en estos momentos en los Estados Unidos para su eventual aprobación. Otra opción dentro de los hidrogeles es CartiFill® (Sewon Cellontech, Corea del Sur), manufacturado a base de aterocolágeno, el cual viene siendo usado desde hace algunos años en varios países (Figura 3).
Uno de los materiales más conocidos y estudiados, y hasta la fecha el único que ha presentado ensayos clínicos aleatorizados es el chitosán.
Chitosán
El chitosán o quitosano es un polisacárido natural derivado de la quitina, siendo este el segundo material más abundante en la naturaleza después de la celulosa. Es ampliamente conocido por sus aplicaciones médicas, para estimular la cicatrización, como terapia antimicrobiana y antihemorrágica, entre otras. De ahí que fuera visto como un material atractivo con fines de ingeniería tisular. Sin embargo, su uso en la ortopedia es relativamente reciente.
Su estructura química es muy similar a la de los GAG (condroitín sulfato y queratán sulfato), componentes muy relevantes de la estructura del cartílago hialino y claves para entender su comportamiento biomecánico. Adicionalmente a esto, el chitosán tiene la habilidad de interactuar con estas sustancias y servir de soporte a la producción de agrecanos y de colágeno de tipo 2; esto lo convierte en un material muy atractivo para la reparación del cartílago articular(23). Además, tiene capacidad de adherencia a la superficie, por lo que no necesita de ningún pegamento adicional.
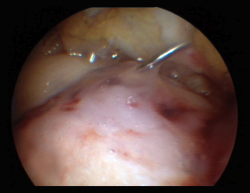
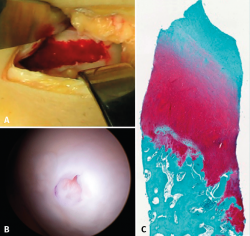
A pesar de sus innegables y probados beneficios, es un material muy inestable y, por lo tanto, la elaboración de los productos que lo contienen presenta grandes desafíos. Una propiedad muy interesante de este biopolímero es que, cuando se encuentra en estado líquido, al llevarlo a la temperatura del cuerpo humano, este pasa a un estado de gel semisólido(24). Este descubrimiento fue de una gran utilidad para buscar una formulación que permitiera ser inyectada en una articulación como la rodilla en el transcurso de una intervención artroscópica y se solidificara in situ a los pocos minutos. Por ello, se decidió utilizarlo como coadyuvante en un procedimiento de BMS. En el año 2005, la firma canadiense BioSyntech –posteriormente Piramal Healthcare (Canadá), Bio-Orthopaedics Division– inició un estudio clínico internacional aleatorizado comparativo, comparando microfracturas solas con microfracturas plus, con su producto BST-CarGel® (actualmente, Smith & Nephew, Wartford, UK). Los resultados, tanto a 12 meses como tras el seguimiento a 5 años, mostraron una superioridad, sostenida en el tiempo de BST-CarGel® sobre la microfractura sola. Esta superioridad se manifestó tanto por la mayor cantidad como por la calidad hialina del tejido formado, medido objetivamente por métodos de resonancia magnética (RM) cuantitativa(25,26) (Figura 4).
reaca.28171.fs2002014-figura4.png
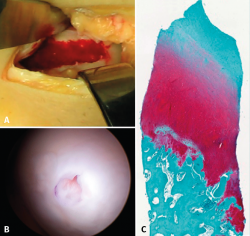
Figura 4. A: amplia lesión condral en el cóndilo interno cubierta por el coágulo tras las microfracturas aumentadas con hydrogel a base de chitosán; B: aspecto artroscópico de la zona totalmente recubierta y orificio de toma de biopsia a los 13 meses; C: aspecto histológico de la zona biopsiada. Nótese el aspecto “hialino” del tejido y la buena interdigitación con el hueso subcondral. Imagen del estudio aleatorizado con BST-CarGel.
Una versión posterior de esta tecnología, desarrollada por el mismo equipo, apareció en 2013, JointRep® (Oligomedic Inc., Laval, Canadá). Esta versión mejorada utiliza una formulación con una consistencia más firme, alcanzando la gelificación en menos de 2 minutos, lo cual facilita la implantación artroscópica y acorta el tiempo quirúrgico. En un estudio comparativo con microfracturas en 69 pacientes, con un seguimiento de 2 años, se encontró una sustancial mejoría clínica (medida con WOMAC –Western Ontario and McMaster Universities Osteoarthritis Index–) con respecto al grupo control(27). Un estudio comparativo aleatorizado multicéntrico, internacional en Australia, Nueva Zelanda y Canadá se encuentra en fase de preparación a finales de 2020.
Conclusiones
Un gesto tan simple y tan utilizado por la medicina desde hace muchos años como es el de crear una zona cruenta que induzca un sangrado, como en los procedimientos propios a la familia de la estimulación de la médula ósea, es susceptible de ser complementado con las herramientas que nos brinda la ingeniería tisular para favorecer, o incluso amplificar, la respuesta biológica necesaria para la reparación tisular en el cartílago articular de naturaleza hialina y así poder obtener resultados aún mejores y de una manera más consistente. Esto es lo que se logra con las microfracturas plus. Dadas las opciones disponibles para mejorar las tasas de éxito con un proceso de “aumentación” de la estimulación de la médula ósea, la utilización habitual de alguna de estas estrategias está plenamente justificada para mejorar los resultados y conservarlos durante un periodo de tiempo más largo. Lo que nos lleva a plantearnos una pregunta final: ¿con la evidencia disponible, es deseable hoy por hoy realizar microfracturas solas?
Figuras
Figura 2. A: aspecto artroscópico de una úlcera con los orificios de las microfracturas sangrantes; B: aspecto de la misma zona recubierta por fibrocartílago 8 meses después.
Figura 4. A: amplia lesión condral en el cóndilo interno cubierta por el coágulo tras las microfracturas aumentadas con hydrogel a base de chitosán; B: aspecto artroscópico de la zona totalmente recubierta y orificio de toma de biopsia a los 13 meses; C: aspecto histológico de la zona biopsiada. Nótese el aspecto “hialino” del tejido y la buena interdigitación con el hueso subcondral. Imagen del estudio aleatorizado con BST-CarGel.
Información del artículo
Cita bibliográfica
Autores
Alberto Restrepo Betancourt
Chief Medical Officer. OligoMedic Inc. Canadá
Javier Vaquero Martín
Jefe de SERVICIO de COT. Hospital General Universitario Gregorio Marañón. Madrid
Catedrático de Cirugía Ortopédica y Traumatología (COT). Universidad Complutense. Madrid
Responsabilidades éticas
Conflicto de interés. El autor Alberto Restrepo es chief medical officer de OligoMedic Inc.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Insall JN. Intra-articular surgery for degenerative arthritis of the knee. A report of the work of the late K. H. Pridie. J Bone Joint Surg (Br). 1967;49-B:211-28.
-
2Steadman JR, Rodkey WG, Rodrigo JJ. Microfracture: surgical technique and rehabilitation to treat chondral defects. Clin Orthop Relat Res. 2001;391(Suppl):S362-9.
-
3McCormick F, Harris JD, Abrams GD, Frank R, Gupta A, Hussey K, et al. Trends in the Surgical Treatment of Articular Cartilage Lesions in the United States: an Analysis of a Large Private-Payer Database Over a Period of 8 Years. Arthroscopy. 2014;30:222-6.
-
4Steadman JR, Rodkey WG, Briggs KK. Microfracture: Its History and Experience of the Developing Surgeon. Cartilage. 2010;1:78-86.
-
5Arshi A, Fabricant PD, Go DE, Williams RJ, McAllister DR, Jones KJ. Can Biologic Augmentation Improve clinical outcomes following microfracture for symptomatic cartilage defects of the knee? A systematic review. Cartilage. 2018;9:146-55.
-
6Gomoll AH. Microfracture and augments. J Knee Surg. 2012;25:9-16.
-
7Vaquero J, Forriol F. Knee chondral injuries: clinical treatment strategies and experimental models. Injury 2012;43:694-705.
-
8Imhof H, Sulzbacher I, Grampp S, Czerny C, Youssefzadeh S, Kainberger F. Subchondral Bone and Cartilage Disease: a Rediscovered Functional Unit. Invest Radiol. 2000;35:581-8.
-
9Madry H, van Dijk CN, Mueller-Gerbl M. The Basic Science of the Subchondral Bone. Knee Surg Sports Traumatol Arthrosc. 2010;18:419-33.
-
10Frisbie DD, Morissete S, Ho CP, Rodkey WG, Steadman JR, McIlwraith CW. Effects of calcified cartilage on healing of chondral defects treated with microfracture in horses. Am J Sports Med. 2006;34:1824-31.
-
11Hunziker EB. Articular cartilage repair: basic science and clinical progress. A review. Osteoarthritis Cartilage. 2001;10:432-63.
-
12Sakaguchi Y, Sekiya I, Yagishita K, Muneta T. Comparison of Human Stem Cells derived from various mesenchymal tissues: superiority of synovium as a cell source. Arthritis Rheum. 2005;52:2521-9.
-
13Bravo B, Guisasola MC, Vaquero J, Tirado I, Gortazar AR, Forriol F. Gene expression, protein profiling, and chemotactic activity of infrapatellar fat pad mesenchymal stem cells in pathologies of the knee joint. J Cell Physiol. 2019;234:18917-27.
-
14Strauss EJ, Barker JU, Kercher JS, Cole BJ, Mithoefer K. Augmentation strategies following the Microfracture technique for repair of focal chondral defects. Cartilage. 2010;1:145-52.
-
15Brittberg M. Cellular and Acellular approaches for cartilage repair: a philosophical analysis. Cartilage. 2015;6(Suppl 2):4S-12S.
-
16Caplan AI. Mesenchymal Stem Cells: The Past, the Present, the Future. Cartilage. 2010;1:6-9.
-
17Caplan AI. Mesenchymal Stem Cells: Time to Change the Name! Stem Cells Trans Med. 2017;6:1445-51.
-
18Somoza RA, Welter JF, Correa D, Caplan AI. Chondrogenic differentiation of Mesenchimal Stem Cells: challenges and unfulfilled expectations. Tissue Eng Part B. 2014;20:596-608.
-
19Benthien JP, Behrens P. Autologous Matrix-Induced Chondrogenesis (AMIC). Combining microfracturing and a collagen I/III matrix for articular cartilage resurfacing. Cartilage. 2010;1:65-8.
-
20Lee YH, Suzer F, Thermann H. Autologous Matrix-Induced Chondrogenesis: a review. Cartilage. 2014;5:145-53.
-
21Steinwachs MR, Kreuz PC. Autologous Chondrocyte Implantation in chondral defects of the knee with a type I/III collagen membrane; a prospective study with a 3 year follow-up. Arthroscopy. 2007;23:381-7.
-
22Steinwachs MR, Gille J, Volz M, Anders S, Jakob R, De Girolamo L, et al. Systematic Review and Meta-Analysis of the Clinical Evidence on the Use of Autologous Matrix-Induced Chondrogenesis in the Knee. Cartilage. 2019 Sep 11:1947603519870846.
-
23Armiento AR, Stoddart MJ, Alini M, Eglin D. Biomaterials for articular cartilage tissue engineering: learning from biology. Acta Biomateralia. 2018;65:1-20.
-
24Chenite A, Chaput C, Wang D, Combes C, Buschmann MD, Hoemann CD, et al. Novel injectable neutral solutions of chitosan form biodegradable gels in situ. Biomaterials. 2000;2155-61.
-
25Stanish WD, McCormack R, Forriol F, Mohtadi N, Pelet S, Desnoyers J, et al. Novel scaffold-based BST-CarGel treatment results in superior cartilage repair compared with microfracture in a randomized controlled trial. J Bone Joint Surg Am. 2013;95:1640-50.
-
26Shive MS, Stanish WD, McCormack R, Forriol F, Mohtadi N, Pelet S, et al. BST-CarGel® Treatment Maintains Cartilage Repair Superiority over Microfracture at 5 Years in a Multicenter Randomized Controlled Trial. Cartilage. 2015;6:62-72.
-
27Pipino G, Risitano S, Alviano F, Wu EJ, Bonsi L, Vaccarisi DC, et al. Microfractures and hydrogel scaffolds in the treatment of osteochondral knee defects: a clinical and histological evaluation. J Clin Orthop Trauma. 2019;10:67-75.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Actualización en el tratamiento de las úlceras condrales de la rodilla
- Comparación de la inyección intraarticular de plasma rico en plaquetas (PRGF®) y ácido hialurónico (Hyalone®) en el tratamiento de las lesiones condrales: estudio clínico prospectivo aleatorizado
- Microfracturas o estimulación de la médula ósea (BMS): la evolución de la técnica
- Injerto de cartílago en fresco. Indicaciones, técnica quirúrgica y evidencia científica
- Condrogénesis inducida por matrices (AMIC)
- Instant CEMTRO Cell (ICC), implante de condrocitos autólogos de alta densidad
- Regenerar el cartílago articular: perspectivas y futuro
- Cirugía de implante de condrocitos autólogos en rodilla
- Úlceras condrales de espesor completo en rótula y cóndilo femoral de rodilla
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.