Regenerar el cartílago articular: perspectivas y futuro
Regeneration of joint cartilage: perspectives and future
Resumen:
Los tratamientos de las lesiones del cartílago cambiaron significativamente desde la incorporación de las técnicas de biotecnología, inicialmente con el cultivo de condrocitos autólogos en un medio líquido, posteriormente con la incorporación de matrices, embebidas o no con células cultivadas. El reto continúa y esas técnicas que han mostrado unos buenos resultados clínicos deben mejorarse para establecer un protocolo que sea capaz de regenerar el tejido cartilaginoso. Desde nuestro punto de vista, los ensayos clínicos y los trabajos de investigación son primordiales, para conocer la biología articular y ser capaces de dirigir la condrogénesis.
Abstract:
The treatment of cartilage lesions changed significantly with the introduction of biotechnological developments, initially in the form of culturing autologous chondrocytes in liquid medium, and later followed by the incorporation of matrixes with or without cultured cells. The challenge continues, and these techniques, which have demonstrated good clinical outcomes, need to be improved in order to establish a protocol capable of regenerating cartilage tissue. From our point of view, clinical trials and research studies are essential in order to better understand joint biology and be able to direct chondrogenesis.
Introducción
Las decisiones del presente, con el trabajo realizado en el pasado, marcan el futuro. En el caso de la reparación de las lesiones del cartílago, son muchos los científicos y cirujanos que han trabajado, con la colaboración de los pacientes, para resolver el mismo problema y encontrar una solución. Aunque un cambio de la dirección que ahora llevamos puede surgir, como ha ocurrido tantas veces en la historia de la ciencia, en cualquier momento.
Han aparecido muchos trabajos relacionados con la reparación del cartílago, aunque no todos tienen el mismo valor, pues hay pocos ensayos clínicos controlados y aleatorizados, y tampoco abundan los metaanálisis con nivel de evidencia I. La mayoría de las publicaciones en las que nos podemos fijar son estudios de cohortes o casos clínicos, con apreciaciones subjetivas con poco apoyo científico. Sin embargo, los tratamientos propuestos para reparar el cartílago alivian los síntomas, fundamentalmente el dolor, mejoran la función y la movilidad articular, y evitan que la lesión progrese(1), aunque llama la atención que tratamientos muy diversos y con principios muy distintos consigan los mismos resultados.
Los tratamientos conservadores incluyen la fisioterapia, los agentes farmacológicos, como los condroprotectores (sulfato de glucosamina, condroitín sulfato, colágeno, diacereína, etc.), y las inyecciones intraarticulares de ácido hialurónico o factores plaquetarios. Desgraciadamente, ninguno de ellos repara ni regenera el cartílago dañado; en el mejor de los casos, pueden aliviar el dolor, mejorar la función y, posiblemente, frenar la progresión. Por otro lado, las técnicas quirúrgicas utilizadas para reparar el cartílago consiguen una sustitución del tejido o una reconstrucción con una evolución incierta a largo plazo y en la mayoría de las ocasiones tampoco obtienen la regeneración completa del tejido dañado, ya que pocas veces se genera un tejido cartilaginoso hialino funcional.
Una de las técnicas que más se ha prodigado ha sido la infiltración de células mesenquimales (MSC). Awad et al.(1), en un metaanálisis con 33 ensayos clínicos de tratamiento con MSC para regenerar el cartílago de la rodilla que incluyen 724 pacientes, comparando el dolor y la función articular, vieron que el concentrado de aspirado de médula ósea reduce el dolor y mejora la función articular(2,3,4).
En un ensayo clínico aleatorizado(5) se asignaron 56 pacientes a 2 grupos; un grupo recibió MSC cultivadas con una inyección de ácido hialurónico a las 3 semanas de la intervención. Estos pacientes mostraron mejoría clínica y de la escala MOCART (Magnetic Resonance Observation of Cartilage Repair) para la resonancia magnética (RM), en comparación con el otro grupo, que había recibido placebo y ácido hialurónico. Además, en 9 pacientes a los que se aplicó MSC, pudo observarse un recubrimiento de tejido cartilaginoso.
La relación entre la edad, la viabilidad de las MSC y la consiguiente evolución del trasplante de cartílago es otro aspecto controvertido. Buda et al.(6) sostienen que la edad, el sexo y el tamaño de la lesión no afectan al resultado. Nejadnik et al.(7) diseñaron un estudio observacional de cohortes, para comparar la reparación de cartílago con condrocitos autólogos (36 pacientes) y con MSC (36 pacientes). La edad no afectó en el grupo de MSC, mientras que los pacientes menores de 45 años tuvieron mejores resultados en el grupo del trasplante autólogo de condrocitos.
Son muchas las variables que se están manejando en el tratamiento de las lesiones condrales. Las lesiones son parecidas; sin embargo, los tratamientos son muy diferentes. Esto obliga a desarrollar recomendaciones y guías basadas en estudios de nivel de evidencia I y con largo tiempo de evolución, que reflejen cuidadosamente las características de las lesiones y los datos completos del tratamiento seguido, que suelen faltar en la mayoría de los estudios. También es necesario valorar las imágenes de RM con las escalas homologadas para establecer un diagnóstico preciso y una correcta evaluación de la evolución. Además, se debe reflejar la historia clínica de los pacientes incluidos, con sus comorbilidades, la medicación previa relacionada con la lesión, cirugías previas, etc.
También se requiere conocer las características de los condrocitos o MSC utilizadas, si proceden de cultivos celulares (son cultivadas) o directamente de un concentrado aspirado, así como el número total de células inyectadas. En caso de emplear aspirados, se debe señalar la técnica utilizada y los datos del aislamiento y procesado, incluyendo la centrifugación y los marcadores de superficie utilizados para caracterizar las células. Si las células estuvieron en cultivo (fueron cultivadas) se deben conocer los tiempos, pases celulares, temperaturas y medios empleados. Cualquier publicación debe contener todos los datos de la técnica empleada, incluyendo el procedimiento quirúrgico, el contenido de la suspensión utilizada para la inyección celular y la denominación clara de cualquier agente adicional que se haya combinado con las células (dexametasona, plasma rico en plaquetas –PRP–).
Los ensayos tendrán que analizar los protocolos postoperatorios y de rehabilitación. En las publicaciones actuales hay una gran variedad de protocolos y de métodos de valoración clínicos, por la imagen o histológicos. Las escalas clínicas y funcionales son muy variadas y poco sensibles. Mayor consistencia tiene el diagnóstico por la imagen, donde la RM es la referencia; sin embargo, no todos establecen las mismas secuencias, ni siguen las mismas escalas de valoración.
Pensando en el futuro, el desarrollo de las nuevas técnicas para la reparación y la regeneración del cartílago articular se tiene que basar en la prevención, la biotecnología enfocada a los factores de crecimiento específicos, el desarrollo de biomarcadores, la terapia génica, un aprovechamiento de la regulación mecánica del cartílago, todo ello basado en una investigación in vitro e in vivo y clínica apoyada en la metodología correcta. Por supuesto, las técnicas quirúrgicas tienen que ser cada vez más precisas y con garantías de obtener mejores resultados, pero de esto ya se han encargado otros capítulos de este suplemento.
La biotecnología
La reparación tras realizar una microfractura demuestra que el organismo tiene el potencial suficiente para conseguir una regeneración, a pesar de que la cantidad y la calidad del tejido reparado no sean óptimas. Este es un campo donde se han desarrollado en los últimos años técnicas que han mejorado los resultados y la calidad del tejido reparado(8,9).
La base de las técnicas de biotecnología son las células en cultivo, bien MSC pluripotenciales o condrocitos. Se han propuesto diferentes abordajes para utilizar MSC de médula ósea(10); la inyección directa intraarticular de MSC autólogas, cultivadas o no cultivadas, es la manera más sencilla para liberar células cuando hay una lesión del cartílago. Otra forma, especialmente en los defectos osteocondrales, es implantar las MSC en una membrana(1). Sin embargo, se necesita clarificar la situación en el manejo y la manipulación con MSC para obtener los mejores y más eficaces resultados y determinar histológicamente el resultado obtenido.
Los estudios in vitro e in vivo han demostrado que tras la implantación de las MSC que se diferencian condrogénicamente, con factores de crecimiento, éstas tienden a adquirir la morfología y las características de los condrocitos hipertróficos, propios del cartílago de crecimiento o de la formación de hueso a través de la osificación endocondral, y esto puede llevar a la formación de un tejido de reparación calcificado(11,12). Los esfuerzos deben dirigirse a la búsqueda de factores que supriman la diferenciación hipertrófica y mantengan el fenotipo del cartílago articular hialino.
Para determinar la eficacia de las MSC alogénicas, un campo que despierta el mayor interés, Vangsness et al.(13) diseñaron un estudio controlado, aleatorio y a doble ciego. Asignaron 2 grupos de pacientes con 3 dosis diferentes de MSC alogénicas, viendo que todos los grupos mejoraron el dolor y la escala de Lysholm, a los 2 años del tratamiento.
Factores de crecimiento
El cartílago hialino es un tejido avascular. Por lo tanto, es difícil esperar una reparación del mismo y se necesitará aportar células o señales capaces de disparar los mecanismos capaces de regenerar el tejido. Las estrategias para reparar el cartílago se han centrado en la estimulación del anabolismo, utilizando factores de crecimiento anabólicos o factores condroinductores (factor de crecimiento transformante β –TGF-β–, proteínas morfogénicas óseas (Bone Morphogenetic Proteins –BMP–), factor de crecimiento de fibroblastos –FGF–). Estos factores pueden inducir la diferenciación de las MSC en células condrocito-like y estimular la producción de matriz cartilaginosa. Cuando se habla de factores de crecimiento, la mayoría de las publicaciones se refieren al PRP, desconociendo el tipo y el número de factores inyectados.
La terapia basada en los factores de crecimiento se ha cuestionado por la necesidad de utilizar grandes dosis, por el corto tiempo de vida de los mismos en el interior de la articulación, su coste y por la posibilidad de lanzar efectos colaterales(14,15,16); esto se debe a que, además del cartílago, en la articulación hay otros tejidos de características muy diferentes (sinovial, hueso esponjoso, hueso subcondral, menisco) y los factores de crecimiento externos conducen a una hiperplasia de la sinovial, inflamación articular o formación ectópica de cartílago o hueso, con dolor y pérdida de movilidad(17). Incluso, como vimos en el menisco, hay factores con efectos contrapuestos según actúen sobre las células del área vascular o del área no vascular(18).
Varios estudios han demostrado que las inyecciones repetidas de TGF-β, BMP2 o BMP9, o la sobreexpresión adenoviral de TGF-β en la rodilla del ratón producen osteofitos(19,20,21,22,23). Por eso, no está claro cuáles son los factores más adecuados, ni tampoco su dosis, para guiar el crecimiento y la diferenciación celular.
Los factores de crecimiento se asocian normalmente con la estimulación de la condrogénesis, aunque estas proteínas también pueden tener, bajo ciertas condiciones, una función anticondrogénica. Un caso conocido es el FGF2, que estimula el crecimiento y la diferenciación condrogénica de las MSC, derivadas del tejido adiposo y de la médula ósea, pero a la vez contrarresta el efecto sinérgico procondrogénico de la BMP2(24,25,26).
La supresión de los factores anticondrogénicos es una forma de estimular la condrogénesis in situ de las MSC articulares (reparación endógena) o de liberar MSC con alto potencial condrogénico (terapia celular)(10). Los factores “anticondrogénicos” incluyen mediadores proinflamatorios y factores inductores de la hipertrofia de los condrocitos maduros.
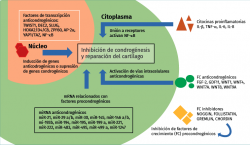
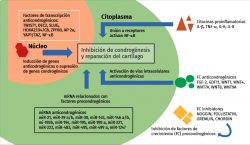
Los reguladores anticondrogénicos que ayudan a mantener el fenotipo condrocítico se han estudiado poco. La inhibición de la condrogénesis puede ser ejercida fisiológicamente a nivel extracelular, con factores de crecimiento, inhibidores de los factores de crecimiento y citocinas proinflamatorias, y a nivel transcripcional/traslacional con los (co)reguladores transcripcionales y los micro-ARN (miRNA). De hecho, muchos inhibidores extracelulares (nogina, folistatina, gremlin y cordina) bloquean la actividad de los factores de crecimiento procondrogénicos y actúan como antagonistas de la BMP(27). También algunas de las proteínas WNT (Wnt1, Wnt4, Wnt7A, Wnt8 y Wnt9A) inhiben la diferenciación condrogénica de las MSC progenitoras(28). Por su parte, la GDF11, activando la NOTCH1, reprime la expresión de los marcadores condrocitarios y la producción de cartílago(29) (Figura 1).
Los factores proinflamatorios
Las citocinas inflamatorias (factor de necrosis tumoral α –TNF-α– o interleucina 1b –IL-1b–) tienen un efecto negativo que afecta tanto a la mecánica del cartílago como a las propiedades de lubricación del líquido sinovial(30).
Dos macromoléculas, lubricina y ácido hialurónico, son los lubricantes primarios para mantener las condiciones del líquido sinovial(31,32,33). La IL inflamatoria IL-1b aumenta sus niveles en la artritis inflamatoria y después de un traumatismo; la sobreexpresión de esta IL se asocia con la pérdida de proteoglicanos y el reblandecimiento de la matriz extracelular(34,35,36). La IL-1b, además, reduce la expresión de lubricina(37) y aumenta la expresión de catepsina B(36,37,38), incrementando la fricción del cartílago(39,40).
Se podría modular la inflamación inhibiendo las señales proinflamatorias como opción terapéutica, para reducir la degeneración del cartílago y crear un microambiente de reparación favorable. Cualquier lesión del cartílago eleva los mediadores extracelulares inflamatorios, incluyendo las citocinas y quimiocinas inflamatorias, producidas por los propios tejidos inflamados y liberadas directamente en el líquido sinovial. Estos factores son fundamentales y necesarios como estímulo inicial para la reparación del tejido, pero su aumento o producción crónica impiden la condrogénesis y degeneran el cartílago recién formado(41). No es de extrañar que algunos mediadores proinflamatorios –IL-1b, TNF-α, moléculas de la familia de la IL-6 y la IL-8– sean también reconocidos como potentes factores anticondrogénicos(42).
Factores de transcripción
La condrogénesis está regulada por muchos factores de transcripción, fundamentalmente el SOX9 y el RUNX2/3, que actúan como reguladores básicos de las MSC y del desarrollo del cartílago. La inhibición de los factores anticondrogénicos de transcripción puede ser otra estrategia sencilla para estimular la formación de cartílago a través de la expresión génica(10). Otros factores de transcripción sobre los cuales también se puede actuar serían el TWIST1, SLUG/SNAIL2, Homebox (HOX), AP-2, YAP1 (Yes Associated Protein-1) y TAZ, estos últimos reguladores negativos de la condrogénesis(43,44).
Micro-ARN
Los mecanismos postranscripcionales actúan en la regulación de la condrogénesis y en la producción de cartílago. Es un nivel de control potente, ya que un único miRNA tiene como objetivo cientos de mRNA. Se ha señalado que durante la condrogénesis a partir de las MSC participan 169 miRNA(45), lo cual defiende la idea de que muchos miRNA son capaces de ejercer funciones anticondrogénicas y que esta supresión es necesaria para que se produzca la condrogénesis. Por ejemplo, el miRNA-195 ejerce una función anticondrogénica focalizado sobre la FGF-18 y esto promueve la condrogénesis, con un efecto protector in vivo sobre las lesiones del cartílago. Varios miRNA inhiben la supresión de los reguladores procondrogénicos transcripcionales; la mayoría pertenecen a la familia del gen SOX. La expresión de miR-145 se correlaciona negativamente con el potencial condrogénico de los progenitores derivados de las células pluripotentes inducidas (iPS)(46). Del mismo modo, miR-145, miR-30, miR-495 y miR-1247 se han caracterizado como miRNA anticondrogénicos que modulan la SOX9(47).
La modulación de los reguladores anticondrogénicos
Los avances de terapia molecular y la biotecnología han desarrollado herramientas poderosas para inhibir la expresión o la función de los reguladores intra- y extracelulares. A nivel extracelular, bloquear los anticuerpos podría inhibir los factores de crecimiento anticondrogénicos y las citocinas, así como los propios factores de crecimiento inhibidores. Esta estrategia se emplea en clínica con la quimioterapia para el tratamiento del cáncer y también en la artritis reumatoide(48,49). A nivel intracelular, la interferencia del ARN (RNAi) se utiliza para bloquear la síntesis y la función de las proteínas reguladoras y los miRNA(10).
La idea de bloquear los miRNA anticondrogénicos está cada vez más aceptada para el tratamiento de las lesiones de cartílago(50). Para ello, se dispone de 3 tipos de inhibidores: los antimiR (antagomiR), oligonucleótidos cortos que secuestran miRNA, que son la posibilidad más común; otra línea son las esponjas moleculares de miRNA que compiten con el mRNA para interactuar con las miRNA(51); y, por último, pequeñas moléculas inhibidoras del miRNA (SMIR), como son el diazobenceno, los benzotiazoles y la neomicina(52), menos populares, pero con la ventaja de liberarse fácilmente y ser estables en un medio líquido.
Los biomarcadores
Una línea de investigación para el futuro y también una necesidad cada vez más acuciante es disponer de biomarcadores adecuados para el cartílago articular, que deben convertirse en un elemento básico para el diagnóstico y el control de la evolución de las lesiones condrales y de la patología involutiva articular. Un biomarcador es un indicador, objetivo y evaluado, del proceso biológico normal, patológico o de una respuesta farmacológica, tras una intervención terapéutica(53). Se han distinguido biomarcadores “secos”, parámetros por la imagen, o “húmedos”, genéticos y bioquímicos que pueden ser detectados en sangre, suero, orina o líquido sinovial y tejidos.
Los biomarcadores potenciales para el cartílago son proteínas o enzimas que reflejan el metabolismo del cartílago. Desde hace tiempo se trabaja sobre biomarcadores que permitan identificar de forma temprana y conocer el grado y la evolución de la artrosis. El Libro blanco de OARSI (Osteoarthritis Research International Society) se produjo como respuesta a la llamada de la Food and Drug Administration (FDA) para determinar los biomarcadores relacionados con la artrosis(54,55).
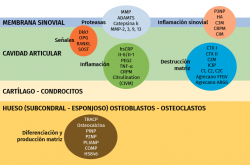
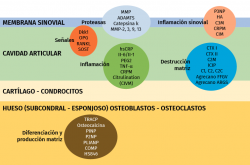
Más del 50% de los pacientes artrósicos en los ensayos clínicos no muestran cambios morfológicos ni clínicos, en 2 años(56); esto hace necesario identificar aquellos pacientes que progresan y cuantificar o, al menos, valorar objetivamente la progresión. Los biomarcadores determinarán la eficacia de un tratamiento e identificarán a los pacientes que precisen tratamiento(57) (Figura 2).
Las metaloproteasas de matriz (MMP) son una familia amplia de proteasas con un amplio rango de sustratos que incluyen los componentes extracelulares, citocinas, receptores y factores de motilidad celular(58,59). Así, la MMP-1 o estromilisina-1 está producida por condrocitos, osteoblastos y células sinoviales que degradan los colágenos de tipo 1, 2 y 3 de la matriz extracelular y median en la degeneración del cartílago(60,61). En la artrosis, la MMP-1 se sobreexpresa en los condrocitos artrósicos(62); la MMP-3 es, en parte, responsable de la degradación de proteínas de la matriz no colagénica en la artritis reumatoide y en la artrosis(61), y se ha visto un aumento de la expresión de MMP-3 y MMP-10 en el cartílago articular y en la sinovial de los pacientes artrósicos. La rotura del colágeno y del agrecano en el cartílago está coordinada por la MMP-9 y la MMP-13. En la artritis reumatoide grave aumentan los niveles séricos de MMP-9(63). El col2 se degrada por las MMP-1, 8, 13 y 14, y es parcialmente degradado por las gelatinasas, MMP-2 y MMP-9 y MMP-3(64). Un campo por estudiar y de posible utilización en el futuro son los inhibidores de las proteasas, conocidos como TIMP.
El TNF-α es un factor inflamatorio que puede activar algunas células para producir MMP(65); relacionado con la liberación de los proteoglicanos del cartílago, contribuye en el proceso catabólico de la artrosis. Los niveles de suero del TNF-α se han asociado con la disminución del espacio articular radiográfico y la pérdida de cartílago(66).
La proteína oligomérica de la matriz del cartílago (COMP), también conocida como trombospondina-5, es una proteína no colagénica que se ha asociado con la degradación del cartílago en la artrosis(67). La concentración sérica de COMP es sensible tras el ejercicio(68). Liphardt et al.(69) demostraron la reducción de COMP, MMP-3 y MMP-9 tras la inmovilización en cama 14 días, pero no ocurrió lo mismo con la TNF-α ni con la MMP-1.
Los traumatismos son un desencadenante de la patogenia artrósica de la rodilla; el 50% de los pacientes con rotura del ligamento cruzado anterior (LCA) desarrollan una artrosis de rodilla 10 a 15 años tras la cirugía(70,71,72,73). Esto sugiere que hay otros factores de riesgo articular, menos conocidos, además de la inestabilidad articular, que afectan a la progresión de la artrosis.
Biomarcadores de fluidos (“húmedos”)
Se ha visto que el lumican y un catabolito suyo de 29 kDa aumentan con la progresión de la artrosis(74,75). El ADAMTS4, una agrecanasa sintetizada por la sinovial artrósica, se asocia con la degradación del agrecano en la zona superficial del cartílago articular(76) y es un marcador de la inflamación en el líquido sinovial(77).
Metabólica y proteómica
En la artrosis, se ha estudiado el fingerprinting metabólico o huella metabólica en cobayas que desarrollan artrosis espontánea(78,79,80). El análisis proteómico del secretoma del cartílago artrósico identifica moléculas con funciones en el proceso patológico y permite el estudio global de las proteínas secretadas y la identificación de nuevos biomarcadores. En un estudio en caballos(81) encontraron una clara disminución de la concentración media de agrecano G3 a medida que avanza la edad de los sujetos de estudio(82).
El perfil proteómico del líquido sinovial en una articulación interfalángica artrósica y normal equina identificó 754 proteínas; 593 fueron significativas, con la escala de Mascot. Las proteínas identificadas incluyen aquellas relacionadas con la matriz, la inflamación, complementos de activación y proteasas. Se identificó un pequeño grupo de 10 proteínas por tener una expresión diferente en el líquido sinovial artrósico que podrían ser candidatas, en el futuro, a biomarcadores de la artrosis(81).
Con los secuenciadores de nueva generación pueden identificarse pequeñas variaciones genómicas y únicas encriptadas en cada genoma individual y localizar los genes transcriptores activos en tejidos individuales(53). Esto permite estudiar detalladamente la transcripción y relacionarla con la sintomatología clínica para establecer una relación causa-efecto. Esta estrategia podría identificar patrones asociados con la intervención terapéutica y el resultado final.
Terapia génica
Otra posibilidad es la terapia génica que, si bien hasta el momento no ha presentado unas indicaciones claras y unos resultados concluyentes, tiene en las articulaciones una de sus mejores posibilidades. Las diartrodias son espacios cerrados donde hay tejidos con una gran capacidad de diferenciación celular, células grasas, MSC y sinoviocitos, con una rica vascularización sinovial.
La terapia génica tiene como objetivo estimular las actividades intrínsecas condrorreparativas a partir de las MSC pluripotenciales de la médula ósea(83); esto se puede conseguir aplicando directamente en el lugar de la lesión los vehículos terapéuticos génicos(84), especialmente los vectores basados en virus adenoasociados recombinantes (rAAV)(85), que soporten la transducción de estas células de manera segura, efectiva y durable, sin alterar su potencial condrogénico(86). Los candidatos condrogénicos para una terapia génica efectiva podrían ser TGF-β, FGF-2, IGF-1 y SOX9(84,85,86,87,88).
El factor de crecimiento similar a la insulina (IGF-1) es un factor anabólico para el tratamiento de la artrosis. Se utilizaron técnicas de terapia génica en un modelo de caballos para producir IGF-1, así como una nueva generación de secuenciadores para establecer un mapa de la respuesta biológica asociada con los efectos de reparación(89). Morscheid et al.(90) consiguieron una sobreexpresión de TGF con IGF-1 por medio de rAAV que mejoró la actividad anabólica, proliferativa y condrogénica de las MSC cultivadas.
La regulación mecánica
Entender y profundizar en la mecanotransducción biológica es uno de los campos de mayor interés; comprender cómo influye la mecánica sobre la biología del cartílago hialino y ver cómo se pueden evitar las influencias de las sobrepresiones y la mala alineación de una extremidad. La mecanotransducción modula las diferenciaciones celulares y su expresión génica; también pueden producir diferenciaciones epigénicas del propio genoma(91).
Hemos insistido en los aspectos biológicos y moleculares de la reparación del cartílago. Sin embargo, no se debe olvidar la influencia mecánica sobre el cartílago y los condrocitos. El condrón responde de manera diferente a como lo hace el condrocito aislado que carece de la matriz pericelular. Esta es la que prepara a las células para responder a las solicitaciones mecánicas. Con la edad, hay una menor respuesta mecánica de los condrocitos, en parte debido a que las señales del TGF-β pasan de un beneficioso ALK-5/SMAD 2/3 a un negativo ALK-1/SMAD1/5/8(92).
Se ha visto que la combinación de solicitaciones a compresión y a cizallamiento del líquido sinovial(93) mejora la morfología del cartílago; estas solicitaciones ayudan a las MSC durante la condrogénesis, en ausencia de factores de crecimiento, pero no se ha encontrado una respuesta adecuada únicamente con la compresión(94,95,96). Sin embargo, la condrogénesis inducida por las MSC por estimulación mecánica no es la misma que cuando se estimula con otras señales, como el TGF-β, ya que la condrogénesis mecánica produce angiopoyetina 2 (ANG2), osteoprotegerina (OPG) y óxido nítrico (NO)(97).
La investigación de la degeneración del cartílago
Son muchos los modelos experimentales utilizados para la investigación del cartílago y de la artrosis. La mayoría de los modelos utilizan la sobrecarga mecánica, directa o traumática, para dañar el cartílago en poco tiempo. Estudios que, a su vez, son realizados in vitro o in vivo. Dos formas de trabajar completamente diferentes con distintos resultados, aunque no son contradictorios(98), más bien se complementan.
En los estudios in vitro, la carga mecánica es la única variable experimental con la que podemos jugar. Sobrecargar los explantes de cartílago in vitro sirve para conocer sus efectos y los cambios que se producen en el cartílago en un periodo de tiempo corto. Por su parte, los estudios in vivo analizan los cambios de pocas semanas hasta meses o años después de provocar la lesión. En los estudios in vitro se controlan los cambios bioquímicos, pero la mayor ventaja de los estudios in vivo es que disponen de un medio biomecánico y biológico para estudiar la degeneración articular en una articulación completa, en todas sus estructuras(98). Los estudios in vitro intentan responder cuestiones básicas y elementales, mientras que los estudios in vivo investigan la respuesta bajo condiciones naturales durante un tiempo mayor.
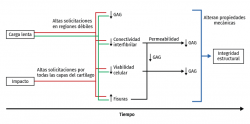
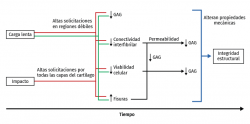
La sobrecarga mecánica in vitro lleva a la rotura inmediata de la capa de cartílago más superficial(99,100) y a la disminución de la viabilidad celular(101). La necrosis y las células apoptóticas aumentan tras un impacto mecánico(102,103) en toda el área impactada. De hecho, las fisuras causadas por la sobrecarga mecánica están siempre rodeadas de células muertas(104,105,106) y, después de un traumatismo por compresión, las células apoptóticas aumentan desde la superficie hacia la profundidad, en relación con el tiempo de compresión. La liberación de prostaglandinas (PG) tras una sobrecarga se produce por la desestructuración de la red de colágeno, que rompe las cadenas de PG y disminuye su densidad(107). La síntesis de glucosaminoglicanos (GAG) también decrece tras altas cargas de compresión, con una disminución de la viabilidad celular(108,109) (Figura 3).
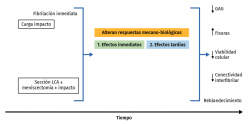
La reducción de la interconectividad fibrilar es el primer signo observado tras las solicitaciones, que debilita el tejido antes de que se observen los cambios de viabilidad celular y la pérdida de GAG en las capas del cartílago superficiales(104,110,111). El aumento progresivo de las solicitaciones lleva a la muerte celular, a la desnaturalización del colágeno y, eventualmente, fisura la superficie(112) (Figura 4).
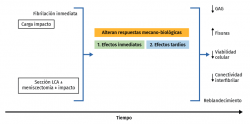
El objetivo de los estudios in vivo de carga sobre el cartílago pretende inducir una artrosis postraumática, utilizando un traumatismo para analizar la progresión de la degeneración articular. La respuesta del cartílago ante una agresión mecánica se puede hacer de manera directa –impacto o cualquier otro protocolo de sobrecarga– o indirecta, alterando la cinemática articular, sección del ligamento cruzado anterior, meniscectomía(113), osteotomías o una sobrecarga repetida largo tiempo por estimulación muscular(114). Estas técnicas producen cambios en el cartílago con el tiempo, presentando fisuración, hipocelularidad, pérdida de la integridad estructural, aumento de GAG seguido de su disminución y reblandecimiento del cartílago(115,116,117). Con estos modelos, la tibia se daña más que el fémur, a pesar de la protección de los meniscos, y hay siempre menos degeneración en la rótula, con un mayor efecto en las zonas que soportan mayores solicitaciones durante la marcha. La fisuración y la pérdida de GAG tienden a empeorar en el tiempo, por eso hay que marcar adecuadamente el tiempo de estudio, pues un cartílago muy degenerado o un cartílago poco degenerado, en un modelo animal, aportan poco al estudio (Figura 4).
Conclusión
Son muchos los campos todavía abiertos que ofrecen expectativas prometedoras para la reparación del cartílago. Todas las innovaciones deben basarse en nuevas ideas, demostradas científicamente a través de trabajos, experimentales y clínicos, que cumplan con la metodología adecuada y publicados en revistas de prestigio. Esto debe eliminar el ruido existente, basado en impresiones a corto tiempo.
Los factores de crecimiento son una de las líneas de tratamiento en el futuro, pero conociendo detalladamente tanto las dosis como el mecanismo de acción. Se dispone de varias maneras de actuar y de diferentes técnicas para hacerlos llegar a sus dianas y que tengan un efecto beneficioso, y siempre controlando los efectos secundarios.
La investigación debe basarse en trabajos anatómicos, biológicos, celulares y de sus señales, así como biomecánicos, para analizar nuevos implantes y nuevas cirugías. Sin olvidar mejorar las técnicas de diagnóstico para evaluar objetivamente los seguimientos y los resultados finales, con técnicas de imagen y con biomarcadores específicos que sean sensibles a cualquier cambio tanto en la estructura como en la composición del cartílago articular.
Figuras
Figura 1. Reguladores anticondrogénicos en la reparación del cartílago. Reguladores anticondrogénicos más importantes extra- e intracelulares y su mecanismo general de acción. Modificado de Lolli et al.(10).
Figura 2. Marcadores más utilizados en la inflamación y la degeneración articular. Modificado de Lotz et al.(57).
Figura 3. Esquema de la respuesta del cartílago a largo plazo según los métodos experimentales de sobrecarga. Modificado de Nickien et al.(98).
Información del artículo
Cita bibliográfica
Autores
Beatriz Bravo Molina
Facultad de Medicina. Universidad San Pablo-CEU. Campus de Montepríncipe. Boadilla del Monte, Madrid
Francisco Forriol Campos
Departamento de Ciencias Morfológicas y Cirugía. Universidad de Alcalá de Henares. Madrid.
Laboratorio de Ortopedia Experimental. Departamento de Cirugía Ortopédica y Traumatología. Clínica Universitaria. Facultad de Medicina. Universidad de Navarra. Pamplona
Laboratorio de Biomecánica. Clínica Universitaria de Navarra. Pamplona
Facultad de Medicina. Universidad San Pablo CEU. Campus de Montepríncipe. Boadilla del Monte. Madrid
Área de Investigación. Hospital FREMAP. Majadahonda. Madrid
Eduardo Álvarez Lozano
Hospital E. González. Universidad Autónoma de Nuevo León. Monterrey, México
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Awad ME, Hussein KA, Helwa I, Abdelsamid MF, Aguilar-Pérez A, Mohsen I, et al. Meta-Analysis and Evidence Base for the Efficacy of Autologous Bone Marrow Mesenchymal Stem Cells in Knee Cartilage Repair: Methodological Guidelines and Quality Assessment. Stem Cells Int. 2019 Apr 7;2019:3826054.
-
2Enea D, Cecconi S, Calcagno S, Busilacchi A, Manzotti S, Gigante A. One-step cartilage repair in the knee: collagen-covered microfracture and autologous bone marrow concentrate. A pilot study. Knee. 2015;22:30-5.
-
3Gobbi A, Scotti C, Karnatzikos G, Mudhigere A, Castro M, Peretti GM. One-step surgery with multipotent stem cells and Hyaluronan-based scaffold for the treatment of full-thickness chondral defects of the knee in patients older than 45 years. Knee Surg Sports Traumatol Arthrosc. 2017;25:2494-501.
-
4Haleem AM, Singergy AA, Sabry D, Atta HM, Rashed LA, Chu CR, et al. The clinical use of human culture-expanded autologous bone marrow mesenchymal stem cells transplanted on platelet-rich fibrin glue in the treatment of articular cartilage defects: a pilot study and preliminary results. Cartilage. 2010;1:253-61.
-
5Wong KL, Lee KB, Tai BC, Law P, Lee EH,Hui JH. Injectable cultured bone marrow-derived mesenchymal stem cells in varus knees with cartilage defects undergoing high tibial osteotomy: a prospective, randomized controlled clinical trial with 2 years' follow-up. Arthroscopy. 2013;29:2020-8.
-
6Buda R, Castagnini F, Cavallo M, Ramponi L, Vannini F, Giannini S. "One-step" bone marrow-derived cells transplantation and joint debridement for osteochondral lesions of the talus in ankle osteoarthritis: clinical and radiological outcomes at 36 months. Arch Orthop Trauma Surg. 2016;136:107-16.
-
7Nejadnik H, Hui JH, Feng Choong EP, Tai BC, Lee EH. Autologous bone marrow-derived mesenchymal stem cells versus autologous chondrocyte implantation: an observational cohort study. Am J Sports Med. 2010;38:1110-6.
-
8Stanish WD, McCormack R, Forriol F, Mohtadi N, Pelet S, Desnoyers J, et al. Novel scaffold-based BST-CarGel treatment results in superior cartilage repair compared with microfracture in a randomized controlled trial. J Bone Joint Surg Am. 2013;95:1640-50.
-
9Shive MS, Stanish WD, McCormack R, Forriol F, Mohtadi N, Pelet S, et al. BST-CarGel® Treatment Maintains Cartilage Repair Superiority over Microfracture at 5 Years in a Multicenter Randomized Controlled Trial. Cartilage. 2015;6:62-72.
-
10Lolli A, Colella F, De Bari C, van Osch GJVM. Targeting anti-chondrogenic factors for the stimulation of chondrogenesis: A new paradigm in cartilage repair. J Orthop Res. 2019;37:12-22.
-
11Scotti C, Tonnarelli B, Papadimitropoulos A, Scherberich A, Schaeren S, Schauerte A, et al. Recapitulation of endochondral bone formation using human adult mesenchymal stem cells as a paradigm for developmental engineering. Proc Natl Acad Sci U S A. 2010;107:7251-6.
-
12Pelttari K, Winter A, Steck E, Goetzke K, Hennig T, Ochs BG, et al. Premature induction of hypertrophy during in vitro chondrogenesis of human mesenchymal stem cells correlates with calcification and vascular invasion after ectopic transplantation in SCID mice. Arthritis Rheum. 2006;54:3254-66.
-
13Vangsness CT Jr, Farr J 2nd, Boyd J, Dellaero DT, Mills CR, LeRoux-Williams M. Adult human mesenchymal stem cells delivered via intra-articular injection to the knee following partial medial meniscectomy: a randomized, double-blind, controlled study. J Bone Joint Surg (Am). 2014;96-A:90-8.
-
14Forriol F. Growth factors in cartilage and meniscus repair. Injury. 2009;40(Suppl 3):S12-6.
-
15Vaquero J, Forriol F. Knee chondral injuries: clinical treatment strategies and experimental models. Injury. 2012;43:694-705.
-
16Curtin CM, Castaño IM, O'Brien FJ. Scaffold-Based microRNA Therapies in Regenerative Medicine and Cancer. Adv Healthc Mater. 2018;7(1).
-
17Chahla J, Dean CS, Moatshe G, Mitchell JJ, Cram TR, Yacuzzi C, et al. Meniscal Ramp Lesions: Anatomy, Incidence, Diagnosis, and Treatment. Orthop J Sports Med. 2016;4:2325967116657815.
-
18Esparza R, Gortazar AR, Forriol F. Cell study of the three areas of the meniscus: effect of growth factors in an experimental model in sheep. J Orthop Res. 2012;30:1647-51.
-
19Van der Kraan P, Matta C, Mobasheri A. Age-related alterations in signaling pathways in articular chondrocytes: implications for the pathogenesis and progression of osteoarthritis. A mini-review. Gerontology. 2017;63:29-35.
-
20Bakker AC, van de Loo FA, van Beuningen HM, Sime P, van Lent PL, van der Kraan PM, et al. Overexpression of active TGF-beta-1 in the murine knee joint: evidence for synovial-layer-dependent chondro-osteophyte formation. Osteoarthritis Cartilage. 2001;9:128-36.
-
21Van Beuningen HM, Glansbeek HL, van der Kraan PM, van den Berg WB. Differential effects of local application of BMP-2 or TGF-beta 1 on both articular cartilage composition and osteophyte formation. Osteoarthritis Cartilage. 1998;6:306-17.
-
22Izal I, Acosta CA, Ripalda P, Zaratiegui M, Ruiz J, Forriol F. IGF-1 gene therapy to protect articular cartilage in a rat model of joint damage. Arch Orthop Trauma Surg. 2008;128:239-47.
-
23Izal I, Ripalda P, Acosta CA, Forriol F. In vitro healing of avascular meniscal injuries with fresh and frozen plugs treated with TGF-beta1 and IGF-1 in sheep. Int J Clin Exp Pathol. 2008;1:426-34.
-
24Enomoto-Iwamoto M, Nakamura T, Aikawa T, Higuchi Y, Yuasa T, Yamaguchi A, et al. Hedgehog proteins stimulate chondrogenic cell differentiation and cartilage formation. J Bone Miner Res. 2000;15:1659-68.
-
25Weiss S, Hennig T, Bock R, Steck E, Richter W. Impact of growth factors and PTHrP on early and late chondrogenic differentiation of human mesenchymal stem cells. J Cell Physiol. 2010;223:84-93.
-
26Hellingman CA, Koevoet W, Kops N, Farrell E, Jahr H, Liu W, et al. Fibroblast growth factor receptors in in vitro and in vivo chondrogenesis: relating tissue engineering using adult mesenchymal stem cells to embryonic development. Tissue Eng Part A. 2010;16:545-56.
-
27Miljkovic ND, Cooper GM, Marra KG. Chondrogenesis, bone morphogenetic protein-4 and mesenchymal stem cells. Osteoarthritis Cartilage. 2008;16:1121-30.
-
28Green JD, Tollemar V, Dougherty M, Yan Z, Yin L, Ye J, et al. Multifaceted signaling regulators of chondrogenesis: Implications in cartilage regeneration and tissue engineering. Genes Dis. 2015;2:307-27.
-
29Watanabe N, Tezuka Y, Matsuno K, Miyatani S, Morimura N, Yasuda M, et al. Suppression of differentiation and proliferation of early chondrogenic cells by Notch. J Bone Miner Metab. 2003;21:344-52.
-
30Goldring SR, Goldring MB. The role of cytokines in cartilage matrix degeneration in osteoarthritis. Clin Orthop Relat Res. 2004;427(Suppl):S27-36.
-
31Schmidt TA, Gastelum NS, Nguyen QT, Schumacher BL, Sah RL. Boundary lubrication of articular cartilage: role of synovial fluid constituents. Arthritis Rheum. 2007;56:882-91.
-
32Bonnevie ED, Galesso D, Secchieri C, Bonassar LJ. Degradation alters the lubrication of articular cartilage by high viscosity, hyaluronic acid-based lubricants. J Orthop Res. 2018;36:1456-64.
-
33Greene GW, Banquy X, Lee DW, Lowrey DD, Yu J, Israelachvili JN. Adaptive mechanically controlled lubrication mechanism found in articular joints. Proc Natl Acad Sci U S A. 2011;108:5255-9.
-
34Arner EC, Hughes CE, Decicco CP, Caterson B, Tortorella MD. Cytokine-induced cartilage proteoglycan degradation is mediated by aggrecanase. Osteoarthritis Cartilage. 1998;6:214-28.
-
35Sandy JD, Thompson V, Verscharen C, Gamett D. Chondrocyte-mediated catabolism of aggrecan: evidence for a glycosylphosphatidylinositol-linked protein in the aggrecanase response to interleukin-1 or retinoic acid. Arch Biochem Biophys. 1999;367:258-64.
-
36Baici A, Lang A. Effect of interleukin-1 beta on the production of cathepsin B by rabbit articular chondrocytes. FEBS Lett. 1990;277:93-6.
-
37Lee Y, Choi J, Hwang NS. Regulation of lubricin for functional cartilage tissue regeneration: a review. Biomater Res. 2018 Mar 16;22:9.
-
38Elsaid KA, Jay GD, Chichester CO. Reduced expression and proteolytic susceptibility of lubricin/superficial zone protein may explain early elevation in the coefficient of friction in the joints of rats with antigen-induced arthritis. Arthritis Rheum. 2007;56:108-16.
-
39Gleghorn JP, Jones AR, Flannery CR, Bonassar LJ. Alteration of articular cartilage frictional properties by transforming growth factor beta, interleukin-1beta, and oncostatin M. Arthritis Rheum. 2009;60:440-9.
-
40Larson KM, Zhang L, Elsaid KA, Schmidt TA, Fleming BC, Badger GJ, et al. Reduction of friction by recombinant human proteoglycan 4 in IL-1α stimulated bovine cartilage explants. J Orthop Res. 2017;35:580-9.
-
41Zhang Y, Pizzute T, Pei M. Anti-inflammatory strategies in cartilage repair. Tissue Eng Part B Rev. 2014;20:655-68.
-
42Fahy N, Farrell E, Ritter T, Ryan AE, Murphy JM. Immune modulation to improve tissue engineering outcomes for cartilage repair in the osteoarthritic joint. Tissue Eng Part B Rev. 2015;21:55-66.
-
43Zhong W, Zhang W, Wang S, Qin J. Regulation of fibrochondrogenesis of mesenchymal stem cells in an integrated microfluidic platform embedded with biomimetic nanofibrous scaffolds. PLoS One. 2013;8:e61283.
-
44Karystinou A, Roelofs AJ, Neve A, Cantatore FP, Wackerhage H, De Bari C. Yes-associated protein (YAP) is a negative regulator of chondrogenesis in mesenchymal stem cells. Arthritis Res Ther. 2015;17:147.
-
45Gabler J, Ruetze M, Kynast KL, Grossner T, Diederichs S, Richter W. Stage-Specific miRs in Chondrocyte Maturation: Differentiation-Dependent and Hypertrophy-Related miR Clusters and the miR-181 Family. Tissue Eng Part A. 2015;21:2840-51.
-
46Diederichs S, Gabler J, Autenrieth J, Kynast KL, Merle C, Walles H, et al. Differential Regulation of SOX9 Protein During Chondrogenesis of Induced Pluripotent Stem Cells Versus Mesenchymal Stromal Cells: a Shortcoming for Cartilage Formation. Stem Cells Dev. 2016;25:598-609.
-
47Chang T, Xie J, Li H, Li D, Liu P, Hu Y. MicroRNA-30a promotes extracellular matrix degradation in articular cartilage via downregulation of Sox9. Cell Prolif. 2016;49:207-18.
-
48Mahajan TD, Mikuls TR. Recent advances in the treatment of rheumatoid arthritis. Curr Opin Rheumatol. 2018;30:231-7.
-
49De Aguiar RB, Parise CB, Souza CR, Braggion C, Quintilio W, Moro AM, et al. Blocking FGF2 with a new specific monoclonal antibody impairs angiogenesis and experimental metastatic melanoma, suggesting a potential role in adjuvant settings. Cancer Lett. 2016;371:151-60.
-
50Yoshizuka M, Nakasa T, Kawanishi Y, Hachisuka S, Furuta T, Miyaki S, et al. Inhibition of microRNA-222 expression accelerates bone healing with enhancement of osteogenesis, chondrogenesis, and angiogenesis in a rat refractory fracture model. J Orthop Sci. 2016;21:852-8.
-
51Lin J, Teo S, Lam DH, Jeyaseelan K, Wang S. MicroRNA-10b pleiotropically regulates invasion, angiogenicity and apoptosis of tumor cells resembling mesenchymal subtype of glioblastoma multiforme. Cell Death Dis. 2012;3:e398.
-
52Connelly CM, Deiters A. Control of oncogenic miRNA function by light-activated miRNA antagomirs. Methods Mol Biol. 2014;1165:99-114.
-
53McIlwraith CW, Kawcak CE, Frisbie DD, Little CB, Clegg PD, Peffers MJ, et al. Biomarkers for equine joint injury and osteoarthritis. J Orthop Res. 2018;36:823-31.
-
54Kraus VB, Burnett B, Coindreau J, Cottrell S, Eyre D, Gendreau M, et al.; OARSI FDA Osteoarthritis Biomarkers Working Group. Application of biomarkers in the development of drugs intended for the treatment of osteoarthritis. Osteoarthritis Cartilage. 2011;19:515-42.
-
55Kraus VB, Blanco FJ, Englund M, Henrotin Y, Lohmander LS, Losina E, et al. OARSI Clinical Trials Recommendations: Soluble biomarker assessments in clinical trials in osteoarthritis. Osteoarthritis Cartilage. 2015;23:686-97.
-
56Karsdal MA, Byrjalsen I, Alexandersen P, Bihlet A, Andersen JR, Riis BJ, et al.; CSMC021C2301/2 investigators. Treatment of symptomatic knee osteoarthritis with oral salmon calcitonin: results from two phase 3 trials. Osteoarthritis Cartilage. 2015;23:532-43.
-
57Lotz M, Martel-Pelletier J, Christiansen C, Brandi ML, Bruyère O, Chapurlat R, et al. Republished: Value of biomarkers in osteoarthritis: current status and perspectives. Postgrad Med J. 2014;90:171-8.
-
58Yong VW, Agrawal SM, Stirling DP. Targeting MMPs in acute and chronic neurological conditions. Neurotherapeutics. 2007;4:580-9.
-
59Morrison CJ, Butler GS, Rodríguez D, Overall CM. Matrix metalloproteinase proteomics: substrates, targets, and therapy. Curr Opin Cell Biol. 2009;21:645-53.
-
60Valdes AM, Spector TD. Genetic epidemiology of hip and knee osteoarthritis. Nat Rev Rheumatol. 2011;7:23-32.
-
61Burrage PS, Mix KS, Brinckerhoff CE. Matrix metalloproteinases: role in arthritis. Front Biosci. 2006;11:529-43.
-
62Bravo B, Argüello JM, Gortazar AR, Forriol F, Vaquero J. Modulation of Gene Expression in Infrapatellar Fat Pad-Derived Mesenchymal Stem Cells in Osteoarthritis. Cartilage. 2018;9:55-62.
-
63Gruber BL, Sorbi D, French DL, Marchese MJ, Nuovo GJ, Kew RR, et al. Markedly elevated serum MMP-9 (gelatinase B) levels in rheumatoid arthritis: a potentially useful laboratory marker. Clin Immunol Immunopathol. 1996;78:161-71.
-
64De Ceuninck F, Sabatini M, Pastoureau P. Recent progress toward biomarker identification in osteoarthritis. Drug Discov Today. 2011;16:443-9.
-
65Cawston TE, Wilson AJ. Understanding the role of tissue degrading enzymes and their inhibitors in development and disease. Best Pract Res Clin Rheumatol. 2006;20:983-1002.
-
66Daghestani HN, Kraus VB. Inflammatory biomarkers in osteoarthritis. Osteoarthritis Cartilage. 2015;23:1890-6.
-
67Saxne T, Heinegård D. Synovial fluid analysis of two groups of proteoglycan epitopes distinguishes early and late cartilage lesions. Arthritis Rheum. 1992;35:385-90.
-
68Niehoff A, Kersting UG, Helling S, Dargel J, Maurer J, Thevis M, et al. Different mechanical loading protocols influence serum cartilage oligomeric matrix protein levels in young healthy humans. Eur J Appl Physiol. 2010;110:651-7.
-
69Liphardt AM, Mündermann A, Andriacchi TP, Achtzehn S, Heer M, Mester J. Sensitivity of serum concentration of cartilage biomarkers to 21-days of bed rest. J Orthop Res. 2018;36:1465-71.
-
70Noé B, Poole AR, Mort JS, Richard H, Beauchamp G, Laverty S. C2K77 ELISA detects cleavage of type II collagen by cathepsin K in equine articular cartilage. Osteoarthritis Cartilage. 2017;25:2119-26.
-
71Frobell RB, Roos EM, Roos HP, Ranstam J, Lohmander LS. A randomized trial of treatment for acute anterior cruciate ligament tears. N Engl J Med. 2010;363:331-42.
-
72Delincé P, Ghafil D. Anterior cruciate ligament tears: conservative or surgical treatment? A critical review of the literature. Knee Surg Sports Traumatol Arthrosc. 2012;20:48-61.
-
73Claes S, Hermie L, Verdonk R, Bellemans J, Verdonk P. Is osteoarthritis an inevitable consequence of anterior cruciate ligament reconstruction? A meta-analysis. Knee Surg Sports Traumatol Arthrosc. 2013;21:1967-76.
-
74Frisbie DD, Mc Ilwraith CW, Arthur RM, Blea J, Baker VA, Billinghurst RC. Serum biomarker levels for musculoskeletal disease in two- and three-year-old racing Thoroughbred horses: a prospective study of 130 horses. Equine Vet J. 2010;42:643-51.
-
75Melrose J, Fuller ES, Roughley PJ, Smith MM, Kerr B, Hughes CE, et al. Fragmentation of decorin, biglycan, lumican and keratocan is elevated in degenerate human meniscus, knee and hip articular cartilages compared with age-matched macroscopically normal and control tissues. Arthritis Res Ther. 2008;10:R79.
-
76Young AA, Smith MM, Smith SM, Cake MA, Ghosh P, Read RA, et al. Regional assessment of articular cartilage gene expression and small proteoglycan metabolism in an animal model of osteoarthritis. Arthritis Res Ther. 2005;7:R852-61.
-
77Wainwright SD, Bondeson J, Caterson B, Hughes CE. ADAMTS-4_v1 is a splice variant of ADAMTS-4 that is expressed as a protein in human synovium and cleaves aggrecan at the interglobular domain. Arthritis Rheum. 2013;65:2866-75.
-
78Reo NV. NMR-based metabolomics. Drug Chem Toxicol. 2002;25:375-82.
-
79Huebner JL, Hanes MA, Beekman B, TeKoppele JM, Kraus VB. A comparative analysis of bone and cartilage metabolism in two strains of guinea-pig with varying degrees of naturally occurring osteoarthritis. Osteoarthritis Cartilage. 2002;10:758-67.
-
80Bravo B, Guisasola MC, Vaquero J, Tirado I, Gortazar AR, Forriol F. Gene expression, protein profiling, and chemotactic activity of infrapatellar fat pad mesenchymal stem cells in pathologies of the knee joint. J Cell Physiol. 2019;234:18917-27.
-
81Peffers MJ, McDermott B, Clegg PD, Riggs CM. Comprehensive protein profiling of synovial fluid in osteoarthritis following protein equalization. Osteoarthritis Cartilage. 2015;23:1204-13.
-
82Beynon RJ, Doherty MK, Pratt JM, Gaskell SJ. Multiplexed absolute quantification in proteomics using artificial QCAT proteins of concatenated signature peptides. Nat Methods. 2005;2:587-9.
-
83Orth P, Rey-Rico A, Venkatesan JK, Madry H, Cucchiarini M. Current perspectives in stem cell research for knee cartilage repair. Stem Cells Cloning. 2014;7:1-17.
-
84Frisch J, Venkatesan JK, Rey-Rico A, Madry H, Cucchiarini M. Current progress in stem cell-based gene therapy for articular cartilage repair. Curr Stem Cell Res Ther. 2015;10:121-31.
-
85Cucchiarini M. Human gene therapy: novel approaches to improve the current gene delivery systems. Discov Med. 2016;21:495-506.
-
86Tao K, Frisch J, Rey-Rico A, Venkatesan JK, Schmitt G, Madry H, et al. Co-overexpression of TGF-β and SOX9 via rAAV gene transfer modulates the metabolic and chondrogenic ativities of human bone marrow-derived mesenchymal stem cells. Stem Cell Res Ther. 2016;7:20-31.
-
87Pagnotto MR, Wang Z, Karpie JC, Ferretti M, Xiao X, Chu CR. Adeno-associated viral gene transfer of transforming growth factor-beta1 to human mesenchymal stem cells improves cartilage repair. Gene Ther. 2007;14:804-13.
-
88Venkatesan JK, Ekici M, Madry H, Schmitt G, Kohn D, et al. SOX9 gene transfer via safe, stable, replication-defective recombinant adeno-associated virus vectors as a novel, powerful tool to enhance the chondrogenic potential of human mesenchymal stem cells. Stem Cell Res Ther. 2012;3:22-36.
-
89O'Hara S, Wang K, Slayden RA, Schenkel AR, Huber G, O'Hern CS, et al. Iterative feature removal yields highly discriminative pathways. BMC Genomics. 2013;14:832.
-
90Morscheid S, Rey-Rico A, Schmitt G, Madry H, Cucchiarini M, Venkatesan JK. Therapeutic Effects of rAAV-Mediated Concomittant Gene Transfer and Overexpression of TGF-β and IGF-I on the Chondrogenesis of Human Bone-Marrow-Derived Mesenchymal Stem Cells. Int J Mol Sci. 2019 May 27;20(10):2591.
-
91Guo XE, Hung CT, Sandell LJ, Silva MJ. Musculoskeletal mechanobiology: a new era for mechano medicine. J Orthop Res. 2018;35:531-2.
-
92Madej W, van Caam A, Davidson EN, Hannink G, Buma P, van der Kraan PM. Aging is associated with reduction of mechanically-induced activation of Smad2/3P signaling in articular cartilage. Osteoarthritis Cartilage. 2016;24:146-57.
-
93Albro MB, Cigan AD, Nims RJ, Yeroushalmi KJ, Oungoulian SR, Hung CT, et al. Shearing of synovial fluid activates latent TGF-β. Osteoarthritis Cartilage. 2012;20:1374-82.
-
94Li Z, Kupcsik L, Yao SJ, Alini M, Stoddart MJ. Mechanical load modulates chondrogenesis of human mesenchymal stem cells through the TGF-beta pathway. J Cell Mol Med. 2010;14:1338-46.
-
95Schätti O, Grad S, Goldhahn J, Salzmann G, Li Z, Alini M, et al. A combination of shear and dynamic compression leads to mechanically induced chondrogenesis of human mesenchymal stem cells. Eur Cell Mater. 2011;22:214-25.
-
96Glatt V, Evans CH, Stoddart MJ. Regenerative rehabilitation: the role of mechanotransduction in orthopaedic regenerative medicine. J Orthop Res. 2019;37:1263-9.
-
97Gardner OF, Fahy N, Alini M, Stoddart MJ. Differences in human mesenchymal stem cell secretomes during chondrogenic induction. Eur Cell Mater. 2016;31:221-35.
-
98Nickien M, Heuijerjans A, Ito K, van Donkelaar CC. Comparison between in vitro and in vivo cartilage overloading studies based on a systematic literature review. J Orthop Res. 2018 Apr 12;36(8):2076-86.
-
99Leucht F, Dürselen L, Hogrefe C, Joos H, Reichel H, Schmitt H, et al. Development of a new biomechanically defined single impact rabbit cartilage trauma model for in vivo-studies. J Invest Surg. 2012;25:235-41.
-
100Malekipour F, Whitton C, Oetomo D, Lee PV. Shock absorbing ability of articular cartilage and subchondral bone under impact compression. J Mech Behav Biomed Mater. 2013;26:127-35.
-
101Jang KW, Buckwalter JA, Martin JA. Inhibition of cell-matrix adhesions prevents cartilage chondrocyte death following impact injury. J Orthop Res. 2014;32:448-54.
-
102Chen CT, Burton-Wurster N, Borden C, Hueffer K, Bloom SE, Lust G. Chondrocyte necrosis and apoptosis in impact damaged articular cartilage. J Orthop Res. 2001;19:703-11.
-
103Patwari P, Gaschen V, James IE, Berger E, Blake SM, Lark MW, et al. Ultrastructural quantification of cell death after injurious compression of bovine calf articular cartilage. Osteoarthritis Cartilage. 2004;12:245-52.
-
104Alexander PG, Song Y, Taboas JM, Chen FH, Melvin GM, Manner PA, et al. Development of a Spring-Loaded Impact Device to Deliver Injurious Mechanical Impacts to the Articular Cartilage Surface. Cartilage. 2013;4:52-62.
-
105Stolberg-Stolberg JA, Furman BD, Garrigues NW, Lee J, Pisetsky DS, Stearns NA, et al. Effects of cartilage impact with and without fracture on chondrocyte viability and the release of inflammatory markers. J Orthop Res. 2013;31:1283-92.
-
106Backus JD, Furman BD, Swimmer T, Kent CL, McNulty AL, Defrate LE, et al. Cartilage viability and catabolism in the intact porcine knee following transarticular impact loading with and without articular fracture. J Orthop Res. 2011;29:501-10.
-
107Rolauffs B, Muehleman C, Li J, Kurz B, Kuettner KE, Frank E, et al. Vulnerability of the superficial zone of immature articular cartilage to compressive injury. Arthritis Rheum. 2010;62:3016-27.
-
108Piscoya JL, Fermor B, Kraus VB, Stabler TV, Guilak F. The influence of mechanical compression on the induction of osteoarthritis-related biomarkers in articular cartilage explants. Osteoarthritis Cartilage. 2005;13:1092-9.
-
109Clements KM, Bee ZC, Crossingham GV, Adams MA, Sharif M. How severe must repetitive loading be to kill chondrocytes in articular cartilage? Osteoarthritis Cartilage. 2001;9:499-507.
-
110Borrelli J Jr, Silva MJ, Zaegel MA, Franz C, Sandell LJ. Single high-energy impact load causes posttraumatic OA in young rabbits via a decrease in cellular metabolism. J Orthop Res. 2009;27:347-52.
-
111Thibault M, Poole AR, Buschmann MD. Cyclic compression of cartilage/bone explants in vitro leads to physical weakening, mechanical breakdown of collagen and release of matrix fragments. J Orthop Res. 2002;20:1265-73.
-
112Cho H, Pinkhassik E, David V, Stuart JM, Hasty KA. Detection of early cartilage damage using targeted nanosomes in a post-traumatic osteoarthritis mouse model. Nanomedicine. 2015 May;11(4):939-46.
-
113Arunakul M, Tochigi Y, Goetz JE, Diestelmeier BW, Heiner AD, Rudert J, et al. Replication of chronic abnormal cartilage loading by medial meniscus destabilization for modeling osteoarthritis in the rabbit knee in vivo. J Orthop Res. 2013;31:1555-60.
-
114Horisberger M, Fortuna R, Valderrabano V, Herzog W. Long-term repetitive mechanical loading of the knee joint by in vivo muscle stimulation accelerates cartilage degeneration and increases chondrocyte death in a rabbit model. Clin Biomech (Bristol, Avon). 2013;28:536-43.
-
115Du G, Zhan H, Ding D, Wang S, Wei X, Wei F, et al. Abnormal Mechanical Loading Induces Cartilage Degeneration by Accelerating Meniscus Hypertrophy and Mineralization After ACL Injuries In Vivo. Am J Sports Med. 2016;44:652-63.
-
116Desando G, Giavaresi G, Cavallo C, Bartolotti I, Sartoni F, Nicoli Aldini N, et al. Autologous Bone Marrow Concentrate in a Sheep Model of Osteoarthritis: New Perspectives for Cartilage and Meniscus Repair. Tissue Eng Part C Methods. 2016;22:608-19.
-
117Burger C, Mueller M, Wlodarczyk P, Goost H, Tolba RH, Rangger C, et al. The sheep as a knee osteoarthritis model: early cartilage changes after meniscus injury and repair. Lab Anim. 2007;41:420-31.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Actualización en el tratamiento de las úlceras condrales de la rodilla
- Comparación de la inyección intraarticular de plasma rico en plaquetas (PRGF®) y ácido hialurónico (Hyalone®) en el tratamiento de las lesiones condrales: estudio clínico prospectivo aleatorizado
- Microfracturas o estimulación de la médula ósea (BMS): la evolución de la técnica
- Injerto de cartílago en fresco. Indicaciones, técnica quirúrgica y evidencia científica
- Condrogénesis inducida por matrices (AMIC)
- Instant CEMTRO Cell (ICC), implante de condrocitos autólogos de alta densidad
- Regenerar el cartílago articular: perspectivas y futuro
- Cirugía de implante de condrocitos autólogos en rodilla
- Úlceras condrales de espesor completo en rótula y cóndilo femoral de rodilla
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.