Comparación de la inyección intraarticular de plasma rico en plaquetas (PRGF®) y ácido hialurónico (Hyalone®) en el tratamiento de las lesiones condrales: estudio clínico prospectivo aleatorizado
Comparison of the intraarticular injection of platelet rich plasma (PRGF®) and hyaluronic acid (Hyalone®) in the treatment of chondral lesions: a randomized, prospective clinical study
Resumen:
Objetivo: comparar el efecto de la inyección intraarticular de plasma rico en plaquetas (PRGF®) y ácido hialurónico (Hyalone®) en el tratamiento de las lesiones degenerativas del cartílago de la rodilla.
Métodos: estudio prospectivo, aleatorizado y abierto, que compara el efecto clínico del tratamiento con PRP (PRGF®) y ácido hialurónico (Hyalone®) en pacientes con lesiones condrales degenerativas (no traumáticas) de rodilla. Se incluyeron 80 pacientes y se aleatorizaron en 2 grupos de 40 pacientes cada uno. La valoración clínica se realizó inicialmente y a los 6 meses del tratamiento mediante las escalas Knee Injury and Osteoarthritis Outcome Score (KOOS), Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC) y la escala visual analógica (EVA).
Resultados: en ambos grupos se produjeron mejorías significativas respecto de los valores basales. Los pacientes tratados con PRP mejoraron en la valoración del dolor por la EVA con respecto al grupo AH, mostrando unas mejorías de 2,08 (1,5) y 0,47 (1,7), respectivamente (PRGF® vs. Hyalone®; p = 0,001). Sin embargo, no se apreciaron diferencias entre ambos grupos tanto en el WOMAC como en la escala KOOS (p > 0,05).
Conclusiones: la inyección intraarticular de PRP no mostró una mejoría clínica consistente respecto al tratamiento con AH a los 6 meses de seguimiento. Aunque se observaron diferencias favorables en la EVA, estas no se tradujeron en el resto de las escalas evaluadas.
Nivel de evidencia: IV.
Abstract:
Objective: To compare the effect of the intraarticular injection of platelet rich plasma (PRGF®) and hyaluronic acid (Hyalone®) in the treatment of degenerative cartilage lesions of the knee.
Methods: A randomized, prospective open-label study was made to compare the clinical effect of treatment with platelet rich plasma (PRP) (PRGF®) and hyaluronic acid (Hyalone®) in patients with degenerative (not traumatic) chondral lesions of the knee. A total of 80 patients were randomized to two groups of 40 patients each. Clinical assessment was made initially and 6 months after treatment using the Knee Injury and Osteoarthritis Outcome Score (KOOS), the Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC) and a visual analogue scale (VAS).
Results: Both groups showed significant improvements with respect to the baseline values. The patients treated with PRP showed greater pain reduction than those treated with hyaluronic acid, according to the VAS, with improvements of 2.08 (1.5) and 0.47 (1.7), respectively (PRGF® versus Hyalone®; p = 0.001). However, neither the WOMAC nor the KOOS showed differences between the two groups (p > 0.05).
Conclusions: The intraarticular injection of PRP did not result in consistent greater clinical improvement versus hyaluronic acid after 6 months of follow-up. Although differences favourable to PRP were recorded with the VAS, they were not confirmed by the rest of the scales used.
Level of evidence: IV.
Introducción
Las lesiones condrales y osteocondrales son un problema frecuente en la práctica clínica diaria del cirujano ortopédico. Su historia natural incluye la evolución hacia la artrosis sintomática, en muchas ocasiones afectando el desarrollo de las actividades de la vida diaria(1,2).
Muchos tratamientos, quirúrgicos y no quirúrgicos, se aplican en la práctica clínica diaria, incluyendo microfracturas, trasplante autólogo de condrocitos y los injertos osteocondrales alogénicos y autólogos. Los resultados clínicos de cada una de las técnicas son variables y no garantizan a largo plazo poder parar el proceso degenerativo(3). Evitar la progresión a la artrosis y poder aliviar el dolor sin intervención quirúrgica son los grandes objetivos buscados en la aplicación de los tratamientos biológicos. Hoy por hoy, el tratamiento final de la artrosis avanzada es la prótesis total de rodilla(4).
El uso del plasma rico en plaquetas (PRP) ha crecido en interés en las últimas décadas. Los resultados de estudios preclínicos en animales han identificado su posible utilidad, estimulando la condrogénesis y la recuperación de la matriz extracelular, sugiriendo, en cierto modo, un efecto regenerador(5,6,7,8). A pesar de esta base preclínica y teórica para el uso de PRP en el tratamiento de las lesiones del cartílago, persiste la controversia sobre su eficacia clínica in vivo. En el año 2013, la Agencia Española del Medicamento calificó al PRP como “medicamento de uso humano”, instando a los investigadores a encontrar las indicaciones, la dosis y la forma de uso precisas para llevar a cabo esta terapia biológica a través de ensayos clínicos para cada una de las patologías y los tipos de PRP. El uso de los distintos PRP es extendido en la práctica clínica diaria, sin haber tenido necesidad legal previa de realizar ensayos clínicos que hayan valorado su seguridad, viabilidad o eficacia, pues no les eran aplicables ni los aspectos regulatorios de un medicamento de fabricación industrial, ni los de los medicamentos de terapia avanzada, como son las células madre mesenquimales cultivadas, a las que se les exige, tanto por la European Medicines Agency (EMA) como por la Food and Drug Administration (FDA), las denominadas condiciones de manipulación y fabricación GMP (good manufacturing practice), en castellano conocidas como normas de correcta fabricación (NCF)(9). Actualmente, la multiplicidad de procedimientos (abiertos o cerrados, con o sin leucocitos, con mayor o menor contenido plaquetario), el modo de aplicación y los pocos ensayos clínicos publicados hacen que no se tengan conclusiones claras sobre el uso del PRP(10,11,12).
El objetivo de este estudio es comparar el efecto clínico de la inyección intraarticular de PRP (PRGF®) y ácido hialurónico (AH, Hyalone®) en el tratamiento de las lesiones degenerativas del cartílago de la rodilla.
Material y métodos
Estudio prospectivo, aleatorizado de manera secuencial 1:1, abierto, realizado entre febrero de 2016 y enero de 2017 en el que se comparó el efecto clínico del tratamiento con PRP (PRGF®) y AH (Hyalone®) en pacientes con lesiones condrales degenerativas (no traumáticas) de rodilla. Se incluyeron un total de 80 pacientes. Todos los pacientes fueron debidamente informados y dieron su consentimiento informado para su inclusión en el estudio. Los pacientes incluidos en el estudio fueron diagnosticados de afectación condral en el compartimento interno de la rodilla según la clasificación de la International Cartilage Regeneration and Joint Preservation Society (ICRS) de 2 a 4 con resonancia magnética(13).
Criterios de inclusión y exclusión
Los pacientes fueron incluidos en el estudio de acuerdo con los siguientes criterios de inclusión y exclusión. Los criterios de inclusión permitían participar a pacientes de ambos sexos de entre 50 y 80 años, con un dolor articular igual o mayor a 2,5 puntos en la escala visual analógica (EVA), con afectación en grado radiológico según la escala de la ICRS de 2 a 4 e índice de masa corporal (IMC) de entre 20 y 35 kg/m2.
Los criterios de exclusión fueron: artrosis bilateral de rodilla que requiera tratamiento en ambas rodillas, diagnóstico previo de enfermedad poliarticular, deformidad mecánica severa (varo/valgo de 15°), artroscopia en esa misma rodilla en los 6 meses anteriores a la inclusión en el estudio, infiltración en esa misma rodilla en los 6 meses anteriores a la inclusión en el ensayo, enfermedad autoinmune o de carácter reumático, discrasia sanguínea, tratamiento con corticoides en los 3 meses previos a la inclusión en el estudio, consumo de antiinflamatorios no esteroideos (AINE) durante los 15 días previos a la inclusión en el ensayo e intolerancia al AH o a proteínas de ave.
Los participantes, asimismo, fueron excluidos del estudio si recibían algún tratamiento infiltrado en la rodilla o si eran sometidos a alguna intervención.
Grupos de tratamiento
Los pacientes fueron aleatorizados a los 2 grupos de tratamiento. El grupo de PRP (PRGF®) (n = 40) fue tratado con una dosis intraarticular de PRP (PRGF®) semanal durante 3 semanas. El grupo de AH (n = 40) recibió una única dosis intraarticular de AH (Hyalone®).
Cálculo del tamaño muestral
Se estimó un tamaño muestral de 60 pacientes (30 pacientes por grupo) como necesario para alcanzar un 95% de poder estadístico para detectar un tamaño de efecto Cohen de 1, asumiendo una desviación estándar para ambos grupos de 10 y un valor alfa de 0,05 (bilateral a 2 colas) y una pérdida de pacientes del 10%. Se decidió incluir a 40 pacientes por grupo, con la idea de evitar el efecto negativo que pudieran tener las pérdidas de seguimiento.
Intervenciones y preparación de l plasma rico en plaquetas (PRGF®-Endoret®)
La medicación fue administrada mediante inyección parapatelar externa por cirujanos dedicados en exclusividad a la cirugía de la rodilla. En ambos grupos se recomendó evitar el deporte de impacto durante las 4 semanas siguientes a la inyección de la primera dosis de tratamiento en el caso del grupo de PRP y de la única dosis en el caso del grupo de AH. Una vez finalizado ese periodo, no hubo restricciones para la actividad.
La obtención del PRP autólogo se realizó a partir de sangre periférica. Una vez extraída la muestra, se centrifuga en el sistema de BTI (PRGF®-Endoret®, BTI Biotechnology Institute, Vitoria-Gasteiz, España) a temperatura ambiente (580 g, 5 min). En el momento previo a la inyección, las plaquetas se activan añadiendo cloruro de calcio al 10% (0,05 mL de cloruro de calcio por mililitro de PRP).
El AH de alto peso molecular utilizado es Hyalone® (60 mg/4 mL, Bioibérica, Barcelona, España) y se aplicó de acuerdo con las instrucciones del fabricante.
Seguimiento clínico
Los pacientes fueron seguidos durante 6 meses desde la infiltración. Durante ese tiempo, las escalas de evaluación fueron remitidas por correo (ordinario o electrónico, según su preferencia) debido a que muchos de los pacientes residen fuera de Pamplona, con imposibilidad para el desplazamiento a nuestro centro en el tiempo determinado. Se utilizaron las escalas Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC)(14), Knee Injury and Osteoarthritis Outcome Score (KOOS)(15) y la escala visual analógica (EVA)(16). Estas escalas fueron valoradas en la visita basal (pretratamiento) y al final del seguimiento (6 meses postratamiento).
Análisis estadístico
Se analizó la normalidad de las variables cuantitativas con la prueba de Kolmogorov-Smirnov. Para la comparación de variables se usó la t de Student (para variables cuantitativas) para variables apareadas o no, según correspondiese, y la Chi-cuadrado (para variables cualitativas). Se utilizó el software Stata 14 (StataCorp 2015, Stata Statistical Software: Release 14. College Station, TX: StataCorp LP). Los resultados se expresan como media (desviación estándar –DS–).
Resultados
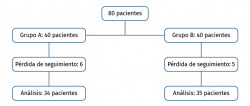
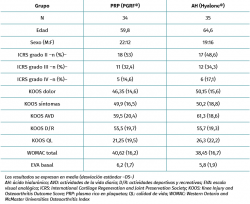
Se incluyeron un total de 80 pacientes y fueron distribuidos al azar (secuencialmente 1:1) en 2 grupos de 40 pacientes cada uno. Fueron excluidos del análisis 6 pacientes en el grupo PRP (4 pacientes no respondieron a los cuestionarios y 2 fueron refractarios al tratamiento) y 5 en el grupo de AH (3 pacientes no respondieron a los cuestionarios y 2 fueron refractarios al tratamiento). De los pacientes considerados como refractarios al tratamiento, 1 del grupo PRP fue intervenido colocando una prótesis total de rodilla. De los 2 en el grupo AH, 1 fue intervenido colocando una prótesis total de rodilla y otro se trató con una infiltración corticoanestésica. Finalmente, 34 pacientes fueron evaluados a los 6 meses en el grupo PRP y 35 en el de AH (Figura 1). Los datos demográficos se encuentran detallados en la Tabla 1. No se encontraron diferencias significativas basales entre los grupos (edad, sexo, ICRS, WOMAC, KOOS y EVA), por lo que los grupos fueron comparables entre sí.
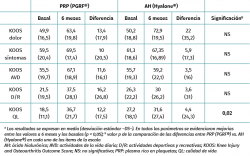
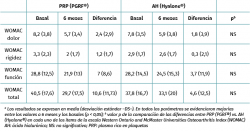
Se encontraron mejorías respecto a los niveles basales en ambos grupos para todas las variables clínicas analizadas (Tablas 2 a 4). La comparación entre los 2 grupos de tratamiento permitió apreciar que, de las 3 escalas evaluadas, solo en la EVA aparecieron diferencias entre ambos grupos, siendo favorables al tratamiento con PRP (PRGF®), con una mejoría de 2,1 (1,5) con respecto al estado basal frente a una mejoría de 0,47 (1,7) en el grupo AH (Hyalone®) (p = 0.001) (Tabla 2). No se identificaron diferencias en los ítems evaluados en la escala KOOS entre ambos grupos, a excepción de la calidad de vida, donde los resultados fueron favorables al tratamiento con PRP (PRGF®) (p = 0,02) (Tabla 3). En la valoración de la escala WOMAC, no objetivamos diferencias entre ambos grupos a pesar de que, en magnitud, las diferencias eran favorables al tratamiento con PRP (PRGF®) (Tabla 4).
Discusión
La inyección intraarticular de PRP (PRGF®) mostró una mejoría clínica en la escala EVA en comparación con el AH (Hyalone®), aunque esta no se tradujo en una mejoría en la función, el dolor y la actividad recreativa según lo reflejado en el resto de las escalas evaluadas (KOOS y WOMAC).
Estos resultados no difieren en gran parte con lo publicado hasta ahora. En un ensayo clínico aleatorizado, ciego, Raeissadat en 2017 encontró una mejoría similar a la nuestra con el uso de PRGF® a los 6 meses de seguimiento, aunque esas diferencias no fueron significativas cuando se las comparaba con AH(17). Más tarde, en 2019, en un nuevo ensayo clínico aleatorizado, los resultados fueron similares a 24 meses, sin encontrar diferencias entre ambos tratamientos(18). Aunque con carácter retrospectivo y un seguimiento menor (5 semanas), Sánchez et al. encontraron una mejora en la reducción del dolor y la calidad de vida con el tratamiento con PRGF®(19). A pesar de esos resultados favorables, el mismo grupo investigador publicó un trabajo multicéntrico, aleatorizado, doble ciego, con 6 meses de seguimiento, comparando el PRGF® y el AH de alto peso molecular (Euflexxa®) en el que no se encontraron diferencias consistentes entre ambos grupos clínicamente significativas(20).
La mitad de nuestros pacientes presentaban lesiones condrales correspondientes a grados moderados-avanzados de artrosis. Se sabe que la inyección intraarticular de PRP (PRGF®) en grados avanzados no parece tener efecto. Kon et al., en 150 pacientes tratados con PRP o AH, observaron una mejora de la funcionalidad y la reducción del dolor con el uso de PRP cuando trataban pacientes jóvenes con menor grado de artrosis(21). Spakova et al., de manera prospectiva, evidenciaron en 120 pacientes esta misma idea, con mejorías significativas en la escala WOMAC(12). Los resultados favorables que presentamos podrían encontrarse a expensas de los grados incipientes, pero confirmar esta teoría requiere un mayor tamaño muestral para su análisis.
La manera del PRP de influir en la historia natural de la artrosis no está determinada; es más probable que sea el efecto antiinflamatorio el que puede explicar la mejoría sintomática que un efecto claramente regenerador(10,11,12,22). El cartílago articular tiene una capacidad curativa limitada. Debido a su naturaleza avascular y alinfática la respuesta reparativa e inflamatoria a través de la circulación sistémica no puede ayudar con la reparación o regeneración del cartílago de manera significativa(10). Aunque las lesiones que afectan al hueso subcondral pueden estimular las células estromales mesenquimales presentes, sabemos que su actividad y su número están muy disminuidas en relación con el grado de artrosis y, por lo tanto, su capacidad regeneradora es cuanto menos controvertida, incluso buscando una estimulación directa sobre ellas a nivel subcondral(23).
La artrosis, aunque muchas veces simplificada por su característica más evidente, la pérdida de cartílago, se encuentra afectada también en su fisiopatología por la sinovial y el hueso subcondral, desencadenando todos ellos el proceso inflamatorio que perpetúa el proceso degenerativo hacia la artrosis establecida(24). De esta forma, aunque existan procedimientos quirúrgicos conocidos que tal vez son más efectivos para el tratamiento de las lesiones condrales y osteocondrales de manera local, hemos preferido utilizar la inyección intraarticular en este caso por intentar actuar de manera global en las estructuras mencionadas. El efecto paracrino propuesto por Woodell-Mat et al. se ha basado en la identificación de distintos factores de crecimiento anabólico derivados de PRP (FGF básico, TGF-β1, TGF-β2, EGF, IGF-I, PDGF-AB, PDGF-BB, VEGF) y citocinas antiinflamatorias (IL-1ra , sTNF-R1, sTNF-RII, IL-4, IL-10, IL-13, IFN-γ), todos ellos con posible aplicación en el tratamiento de la artrosis(25).
El uso de PRGF® con respecto al uso de otros tipos de PRP también es controvertido. Las preparaciones de PRP varían ampliamente en contenido plaquetario y leucocitario, modo de activación y no solo entre sistemas abiertos o cerrados y entre casas comerciales, sino también entre los propios pacientes. Pocos son los estudios que comparan distintas formulaciones de PRP. Filardo et al. analizaron la eficacia de 2 preparaciones de PRP en la gonartrosis (PRGF versus PRP con leucocitos) y encontraron resultados positivos similares, aunque los efectos adversos en el dolor y la rigidez se observaron con mayor frecuencia cuando se usó PRP con leucocitos(26).
El presente estudio no está exento de limitaciones. En primer lugar, las infiltraciones no se realizaron guiadas por ecografía. Aunque esta es una limitación que pudiera afectar al resultado del procedimiento, creemos que esto no debe afectar a las diferencias observadas, puesto que es un sesgo presente en ambos grupos. De la misma manera, dado que las infiltraciones fueron realizadas por cirujanos especialistas en cirugía de rodilla y la mayor parte de ellas por un cirujano con más de 30 años de dedicación a ella, el valor de la ecografía, en este caso específico, es menor.
En segundo lugar, 6 meses es un periodo corto en el que no es posible valorar el efecto a largo plazo sobre el proceso degenerativo, pero dados los resultados encontrados, no consideramos que las diferencias sean sustancialmente superiores aumentando el seguimiento.
Adicionalmente, la ausencia de restricciones de AINE orales durante el seguimiento puede afectar a los resultados finales, aunque esta ausencia de restricción está presente en los 2 grupos. Por último, no se trata de un trabajo ciego, por lo que el efecto placebo del uso de PRP puede estar presente y ser, presumiblemente, mayor que en el grupo de AH.
Conclusiones
La inyección intraarticular de PRP (PRGF®) no mostró una mejoría clínica consistente a los 6 meses de seguimiento con respecto al tratamiento con AH (Hyalone®). Aunque se observaron diferencias favorables en la escala EVA, estas no se tradujeron en el resto de las escalas evaluadas (KOOS y WOMAC).
Figuras
Tablas
Tabla 1. Datos demográficos. No hubo diferencias significativas entre ambos grupos en ningún parámetro basal (p > 0,05)
Tabla 3. Resultados de la escala WOMAC: grupo PRP (PRGF ®) en comparación con el grupo AH (Hyalone®)a
Información del artículo
Cita bibliográfica
Autores
José María Lamo de Espinosa Vázquez de Sola
Departamento de Cirugía Ortopédica y Traumatología. Clínica Universidad de Navarra. Pamplona
Martín Iglesias Curras
Departamento de Cirugía Ortopédica y Traumatología. Clínica Universidad de Navarra. Pamplona
Andrés Valentí Azcárate
Departamento de Cirugía Ortopédica y Traumatología. Clínica Universidad de Navarra. Pamplona
Juan Ramón Valenti Nin
Facultad de Medicina. Departamento de Cirugía Ortopédica y Traumatología. Clínica Universitaria de Navarra. Pamplona
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Federico DJ, Lynch JK, Jokl P. Osteochondritis dissecans of the knee: a historical review of etiology and treatment. Arthroscopy. 1990;6:190-7.
-
2Van Dijk CN, Reilingh ML, Zengerink M, van Bergen CJ. The natural history of osteochondral lesions in the ankle. Instr Course Lect. 2010;59:375-86.
-
3Kellett CF, Boscainos PJ, Gross AE. Surgical options for articular defects of the knee. Expert Rev Med Devices. 2006;3:585-93.
-
4Buckwalter JA, Saltzman C, Brown T. The impact of osteoarthritis: implications for research. Clin Orthop Relat Res. 2004;427 Suppl:S6-15.
-
5Hunter, D.J., Viscosupplementation for osteoarthritis of the knee. N Engl J Med. 2015;372(11):1040-7.
-
6Kon E, Filardo G, Delcogliano M, Fini M, Salamanna F, Giavaresi G, et al. Platelet autologous growth factors decrease the osteochondral regeneration capability of a collagen-hydroxyapatite scaffold in a sheep model. BMC Musculoskelet Disord. 2010;11:220.
-
7Milano G, Deriu L, Sanna Passino E, Masala G, Manunta A, Postacchini R, et al. Repeated platelet concentrate injections enhance reparative response of microfractures in the treatment of chondral defects of the knee: an experimental study in an animal model. Arthroscopy. 2012 May;28(5):688-701.
-
8Milano G, Deriu L, Sanna Passino E, Masala G, Saccomanno MF, Postacchini R, Fabbriciani C. The effect of autologous conditioned plasma on the treatment of focal chondral defects of the knee. An experimental study. Int J Immunopathol Pharmacol. 2011 Jan-Mar;24(1 Suppl 2):117-24.
-
9Resolución de la AEMPS por la que se establece el uso terapéutico no sustitutivo del plasma autólogo y sus fracciones, componentes o derivados como medicamento de uso humano. AEMPS; mayo de 2013.
-
10Khoshbin A, Leroux T, Wasserstein D, Marks P, Theodoropoulos J, Ogilvie-Harris D, et al. The efficacy of platelet-rich plasma in the treatment of symptomatic knee osteoarthritis: a systematic review with quantitative synthesis. Arthroscopy. 2013;29(12):2037-48.
-
11Patel S, Dhillon MS, Aggarwal S, Marwaha N, Jain A. Treatment with platelet-rich plasma is more effective than placebo for knee osteoarthritis: a prospective, double-blind, randomized trial. Am J Sports Med. 2013;41(2):356-64.
-
12Spaková T, Rosocha J, Lacko M, Harvanová D, Gharaibeh A. Treatment of knee joint osteoarthritis with autologous platelet-rich plasma in comparison with hyaluronic acid. Am J Phys Med Rehabil. 2012;91(5):411-7.
-
13Brittberg M, Winalski CS. Evaluation of cartilage injuries and repair. J Bone Joint Surg Am. 2003;85-A(Suppl 2):58-69.
-
14Bellamy N, Buchanan WW, Goldsmith CH, Campbell J, Stitt LW. Validation study of WOMAC: a health status instrument for measuring clinically important patient relevant outcomes to antirheumatic drug therapy in patients with osteoarthritis of the hip or knee. J Rheumatol. 1988;15(12):1833-40.
-
15Roos EM, Lohmander LS. The Knee injury and Osteoarthritis Outcome Score (KOOS): from joint injury to osteoarthritis. Health Qual Life Outcomes. 2003;1:64.
-
16Wewers ME, Lowe NK. A critical review of visual analogue scales in the measurement of clinical phenomena. Res Nurs Health. 1990;13(4):227-36.
-
17Raeissadat SA, Rayegani SM, Ahangar AG, Abadi PH, Mojgani P, Ahangar OG. Efficacy of Intra-articular Injection of a Newly Developed Plasma Rich in Growth Factor (PRGF) Versus Hyaluronic Acid on Pain and Function of Patients with Knee Osteoarthritis: a Single-Blinded Randomized Clinical Trial. Clin Med Insights Arthritis Musculoskelet Disord. 2017;10:1179544117733452.
-
18Di Martino A, Di Matteo B, Papio T, Tentoni F, Selleri F, Cenacchi A, et al. Platelet-Rich Plasma Versus Hyaluronic Acid Injections for the Treatment of Knee Osteoarthritis: Results at 5 Years of a Double-Blind, Randomized Controlled Trial. Am J Sports Med. 2019;47(2):347-54.
-
19Sánchez M, Anitua E, Azofra J, Aguirre JJ, Andia I. Intra-articular injection of an autologous preparation rich in growth factors for the treatment of knee OA: a retrospective cohort study. Clin Exp Rheumatol. 2008;26(5):910-3.
-
20Sánchez M, Fiz N, Azofra J, Usabiaga J, Aduriz Recalde E, García Gutiérrez A, et al. A randomized clinical trial evaluating plasma rich in growth factors (PRGF-Endoret) versus hyaluronic acid in the short-term treatment of symptomatic knee osteoarthritis. Arthroscopy. 2012;28(8):1070-8.
-
21Kon E, Mandelbaum B, Buda R, Filardo G, Delcogliano M, Timoncini A, et al. Platelet-rich plasma intra-articular injection versus hyaluronic acid viscosupplementation as treatments for cartilage pathology: from early degeneration to osteoarthritis. Arthroscopy. 2011;27(11):1490-501.
-
22Cole BJ, Karas V, Hussey K, Pilz K, Fortier LA. Hyaluronic Acid Versus Platelet-Rich Plasma: a Prospective, Double-Blind Randomized Controlled Trial Comparing Clinical Outcomes and Effects on Intra-articular Biology for the Treatment of Knee Osteoarthritis. Am J Sports Med. 2017;45(2):339-46. Erratum in: Am J Sports Med. 2017;45(5):NP10.
-
23Simon LS. Osteoarthritis. Curr Rheumatol Rep. 1999;1(1):45-7.
-
24Madry H, Kon E, Condello V, Peretti GM, Steinwachs M, Seil R, et al. Early osteoarthritis of the knee. Knee Surg Sports Traumatol Arthrosc. 2016;24(6):1753-62.
-
25Woodell-May J, Matuska A, Oyster M, Welch Z, O'Shaughnessey K, Hoeppner J. Autologous protein solution inhibits MMP-13 production by IL-1β and TNFα-stimulated human articular chondrocytes. J Orthop Res. 2011;29(9):1320-6.
-
26Filardo G, Kon E, Buda R, Timoncini A, Di Martino A, Cenacchi A, et al. Platelet-rich plasma intra-articular knee injections for the treatment of degenerative cartilage lesions and osteoarthritis. Knee Surg Sports Traumatol Arthrosc. 2011;19(4):528-35.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Actualización en el tratamiento de las úlceras condrales de la rodilla
- Comparación de la inyección intraarticular de plasma rico en plaquetas (PRGF®) y ácido hialurónico (Hyalone®) en el tratamiento de las lesiones condrales: estudio clínico prospectivo aleatorizado
- Microfracturas o estimulación de la médula ósea (BMS): la evolución de la técnica
- Injerto de cartílago en fresco. Indicaciones, técnica quirúrgica y evidencia científica
- Condrogénesis inducida por matrices (AMIC)
- Instant CEMTRO Cell (ICC), implante de condrocitos autólogos de alta densidad
- Regenerar el cartílago articular: perspectivas y futuro
- Cirugía de implante de condrocitos autólogos en rodilla
- Úlceras condrales de espesor completo en rótula y cóndilo femoral de rodilla
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.