Instant CEMTRO Cell (ICC), implante de condrocitos autólogos de alta densidad
Instant CEMTRO Cell (ICC), high density autologous chondrocytes implantation
Resumen:
La medicina regenerativa es una nueva disciplina de la medicina, con un futuro muy prometedor para el tratamiento de muchas dolencias que aquejan al ser humano. Para muchas enfermedades todavía está en fase de experimentación. Uno de los campos en los que más ha avanzado es en el tratamiento del cartílago, desde la utilización de cultivos de condrocitos autólogos en medio líquido, al empleo de biomateriales como la membrana de colágeno I/III y, finalmente, al aumento de dosis celular en la técnica ICC. Por ello, en las lesiones de cartílago de grado III/IV de Outerbridge de rodilla, tobillo y ahora ya en cadera, podemos usar la técnica de implante de condrocitos en membrana (ICC), consiguiendo la regeneración del tejido cartilaginoso.
Se trata de medicina regenerativa, pues se forma un tejido cartilaginoso de naturaleza hialina con la misma estructura y función que el cartílago articular sano. Además, los pacientes presentan una recuperación funcional excelente, consiguiendo la vuelta al deporte en muchas ocasiones.
Abstract:
Regenerative medicine is a novel medical discipline with very promising perspectives for the treatment of numerous human disease conditions. In many such conditions it is still in the experimental phase. One of the fields in which the greatest advances have been made is cartilage treatment, ranging from the use of autologous chondrocyte cultures in a liquid medium to the utilization of biomaterials such as type I/III collagen membranes, and lastly cell dose augmentation with the Instant CEMTRO Cell (ICC) implantation of chondrocytes in membrane technique. In this regard, in Outerbridge grade III/IV cartilage lesions of the knee, ankle and now also the hip, the ICC technique can be used to regenerate the cartilage tissue.
This is a regenerative medical technique, since hyaline cartilage tissue is formed with the same structure and function as the healthy joint cartilage. Furthermore, patients experience excellent functional recovery and are often able to return to sports activities.
Introducción
Aunque la causa más frecuente de daño cartilaginoso es la idiopática o degenerativa, otra causa que frecuentemente produce daño del cartílago articular es la traumática (Figura 1A), es decir, el traumatismo articular, seguido de la osteocondritis disecante (OCD)(1,2) (Figura 1B).
Otras causas que originan cambios degenerativos articulares son las inestabilidades articulares por fallos que producen lesiones en meniscos y cartílago por cizallamiento o las malas alineaciones del eje articular de la rodilla que, por mecanismo de sobrecarga o compresión, producen un daño articular progresivo que puede ser asimétrico al afectar al compartimento interno, externo o femoropatelar de modo aislado y, al progresar, acaban produciendo una afectación tricompartimental con artrosis generalizada de la rodilla, para lo que solo resta la sustitución articular o la fijación de la articulación(1,2).
Los defectos condrales pueden ser parciales o totales en función de que afecten al espesor completo del cartílago y llegue a afectarse el hueso subcondral, en cuyo caso se activa un mecanismo de reparación que no llega a producir cartílago articular normal, sino un tejido de reparación que no cumple con las características biomecánicas del cartílago hialino sano, debido a una disminución del colágeno de tipo II, que es reemplazado por el de tipo I, y también al reemplazamiento de los condrocitos por fibroblastos, que no son capaces de producir una matriz extracelular con la concentración adecuada de colágeno de tipo II(3,4) (Figura 2).
Clasificación de las lesiones del cartílago
Aunque existen varias clasificaciones para valorar el grado de lesión del cartílago articular, la más comúnmente empleada en la rodilla es la clasificación de Outerbridge (1961), que establece 4 grados(5,6) (Figura 3):
• Grado I: reblandecimiento o edema de la superficie del cartílago.
• Grado II: fisuras o fragmentación en una superficie menor de 1,25 cm de diámetro.
• Grado III: fisuras o fragmentación en una superficie mayor de 1,25 cm de diámetro.
• Grado IV: la erosión del cartílago afecta hasta el hueso subcondral.
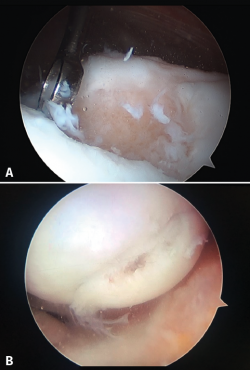
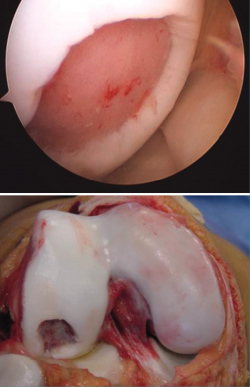
En la Figura 4 observamos imágenes artroscópicas de lesiones de grado II (Figura 4A), de grado III (Figura 4B) y de grado IV (Figura 4C).
reaca.28171.fs1909039-figura5.png
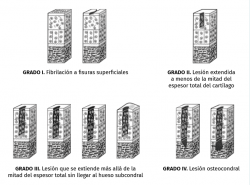
Figura 5. Esquema de la clasificación de las lesiones del cartílago articular según la Sociedad Internacional para la Reparación del Cartílago (ICRS). Figura adaptada del formulario de evaluación de lesiones condrales. ICRS Cartilage Injury valuation Package; 2000. Recuperado de: https://cartilage.org/content/uploads/2014/10/ICRS_evaluation.pdf.
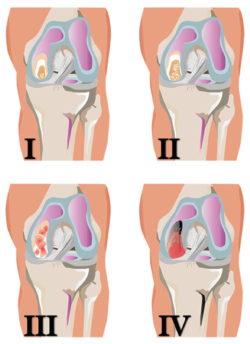
La clasificación de la International Cartilage Repair Society (ICRS) establece también 4 grados, pero tiene subgrados(7) (Figura 5):
• Grado 0: normal.
• Grado 1: cercano a lo normal.
– A: fibrilación superficial o reblandecimiento del cartílago.
– B: fisuras superficiales o laceraciones.
• Grado 2: anormal, lesiones de < 50% de la profundidad del cartílago.
• Grado 3: severamente anormal.
– A: lesiones > 50% de la profundidad del cartílago, sin alcanzar la lámina calcificada.
– B: lesiones > 50% de la profundidad del cartílago, abarcando la lámina calcificada.
– C: defecto total con compromiso de la placa ósea subcondral.
– D: se incluyen ampollas.
• Grado 4: severamente anormal.
– A: lesiones osteocondrales que se extienden hasta la placa ósea osteocondral.
– B: defectos profundos que abarcan al hueso trabecular.
La clasificación de las lesiones del cartílago sirve para objetivar la lesión e intentar establecer un protocolo de tratamiento. Aunque no son cien por cien fiables, parece haber un consenso en cuanto a su uso, especialmente de las que se basan en una clasificación a partir de la visión directa(8).
La mejora del conocimiento de la patología del cartílago y las mejoras de las imágenes obtenidas en radiodiagnóstico nos permitirán tener clasificaciones fiables, antes de llegar a necesitar una artroscopia, lo que nos permitirá tratar el cartílago desde sus primeros grados de lesión.
Medicina regenerativa
La medicina regenerativa, término acuñado en 1999 por William Haseltine, constituye uno de los hitos alcanzados por la ciencia en los últimos años, ayudado por los grandes avances conseguidos en la biología tras el desciframiento del genoma y del epigenoma humano(9). En el genoma se encuentran escritas las instrucciones de cómo son y cómo van a funcionar nuestras células y el epigenoma proporciona las órdenes que regulan la activación de los genes y las funciones celulares. La medicina regenerativa constituye una rama de la investigación traslacional que persigue el reemplazamiento de células, tejidos u órganos dañados con el fin de restablecer su estructura y función. El principal objetivo de este nuevo campo de la medicina es el restablecimiento de funciones u órganos que se han perdido y se podría alcanzar desde varias perspectivas(10,11).
Células, tejidos, órganos y sistemas
Durante el desarrollo embrionario, una célula, el zigoto, va a multiplicarse dando lugar a más células, que a su vez se irán dividiendo y diferenciando según las funciones que van a desempeñar más tarde y, finalmente, formarán un individuo completo(12). A lo largo de este proceso, las células se irán organizando en estructuras de complejidad creciente. La célula es la unidad morfológica y funcional de la vida. En un organismo pluricelular, el primer nivel de organización celular lo constituyen los tejidos. Estos están compuestos por células distintas que comparten un origen embrionario común y que actuando juntas realizan una función común. De acuerdo con su estructura y función, existen 4 tipos principales de tejidos en el organismo: el tejido epitelial, el tejido conectivo, el tejido muscular y el tejido nervioso.
El tejido normal consta esencialmente de 3 componentes(12):
• Matriz extracelular o conjunto de materiales de naturaleza bioquímica compleja que rodean las células y donde estas están embebidas y que proporciona el soporte y armazón de los tejidos. La matriz extracelular conecta unas células con otras dentro de un tejido actuando de medio cohesivo e integrador, fundamental para que las células trabajen de modo cooperativo.
• Mediadores químicos o moléculas que actúan a través de receptores como señales de comunicación del medio externo con las células que forman el tejido y tienen la capacidad de modular la respuesta celular.
• Células, que son las unidades funcionales vivas de los tejidos y tienen la capacidad de división y síntesis de moléculas para interaccionar con el medio.
El siguiente nivel de organización lo constituyen los órganos, formados por la agrupación de 2 o más tejidos distintos para realizar una función determinada. Finalmente, los tejidos y órganos se agrupan formando sistemas para la realización de funciones fisiológicas determinadas, como por ejemplo la respiración o la digestión(12).
Por todo ello, lo que estamos realizando es crear un tejido a partir de las células que lo componen. Ellas son las que producen la matriz extracelular.
Regeneración vs. reparación
Todos los tejidos están sometidos a un constante proceso de renovación, donde se produce muerte celular y renovación tisular. Es un proceso constante y su duración, y sobre todo la extensión de esta renovación, dependen del tipo de tejido del que se trate. También hay que considerar que este proceso no es perfecto y su eficiencia se va perdiendo con la edad, lo que puede ocasionar en ocasiones determinadas patologías y está relacionado en último término con el envejecimiento. La restauración de un tejido u órgano dañado puede seguir 2 caminos distintos e independientes: la regeneración, cuando se forma un tejido igual que el tejido lesionado, o la reparación, cuando se forma un tejido de características similares, pero no igual, que en algunas ocasiones puede simular las funciones del tejido original (cicatrices en la piel tras una herida), pero otras muchas no(13).
La célula como medicamento
La medicina regenerativa combina técnicas de biología celular y otras disciplinas para la producción de nuevos órganos y tejidos(11). A finales del siglo XX y principios del XXI nace esta nueva aproximación a la sustitución de órganos y tejidos, en la que la verdadera protagonista es la célula(14). Este camino comenzó en el siglo XIX cuando científicos como Roux y Ringer desarrollaron técnicas para cultivar células in vitro, es decir, lejos de su ámbito natural. En lo que quedaba del siglo XIX y sobre todo a lo largo del siglo XX, estas técnicas se han perfeccionado y han surgido una gran variedad de avances tecnológicos como las cabinas de flujo laminar, los incubadores de células, los biorreactores o salas blancas, entre otros, que han posibilitado la realización de cultivos celulares de manera rutinaria y sobre todo segura, evitando el problema mayor de los mismos, que es la contaminación por parte de microorganismos. Todo ello nos permite hoy en día hablar de la célula como medicamento, pues se pueden cultivar en las mismas condiciones y en entornos tan estériles y controlados que son propios de los medicamentos(14).
Para que la aplicación de la célula como medicamento sea segura, es necesario que en su utilización y por supuesto en su fabricación intervengan los organismos reguladores. En 2007 se elabora la Directiva Europea en la que se define por primera vez en qué consisten estos nuevos medicamentos basados en el empleo de células. Los engloban en una nueva categoría de fármacos denominados medicamentos de terapias avanzadas, en los que incluyen 3 tipos de medicamentos(15). Es curioso el nombre de terapias avanzadas, pero los legisladores hacen hincapié en que no quiere significar el “retraso” de los medicamentos tradicionales, sino que hace referencia a que es un medicamento cuyo principal componente está vivo y se llega a él principalmente a través de cultivos de células de organismos superiores y de un largo proceso de investigación. Dentro de esta gran categoría de medicamentos de terapias avanzadas, se distinguen 3 tipos: terapia celular, ingeniería tisular y terapia génica(15) (Tabla 1).
Esta Directiva Europea, además, legisla el modo en que se han de realizar los cultivos de estas células que van a tener un papel terapéutico: puesto que son medicamentos, las células tienen que cultivarse en un entorno “limpio” o estéril, que es el mismo que se emplea para fabricar otros medicamentos(15,16). La normativa exige además que, para que estas células alcancen la categoría de medicamentos, la “fabricación” o, mejor dicho, el cultivo de las mismas debe realizarse siguiendo unas normas de calidad que se conocen como normas de correcta fabricación (good manufacturing practices –GMP–)(16). Solo así las células de un medicamento de terapias avanzadas van a tener una calidad terapéutica y podrán ser implantadas en seres humanos(16).
Terapias consolidadas
En el año 2014 se publicó en el Boletín Oficial del Estado un Real Decreto por el que se regulaba la producción no industrial de medicamentos y se hablaba por primera vez de conceptos como cláusula de exclusión y de terapias consolidadas. Se reconocía por primera vez el carácter especial de los medicamentos de terapias avanzadas y sobre todo una diferencia fundamental con los medicamentos tradicionales en el modo de producción. Mientras que los primeros se producen en plantas de producción industrial, los medicamentos basados en células se suelen producir en salas blancas ubicadas en instalaciones con acreditación GMP y de modo no industrial, en especial aquellos de carácter autólogo(17). En dicha ley se reconoce que todas las terapias celulares, excepto las reconocidas como terapias consolidadas, tienen que pasar por todas las fases de investigación clínica hasta ser aprobadas como medicamento. Se conocen como terapias consolidadas aquellas cuya seguridad y eficacia ha sido demostrada a lo largo de años de utilización en seres humanos, antes de que la terapia celular fuera clasificada como medicamento, con numerosa evidencia científica de apoyo. En la ley se reconocen 3 terapias consolidadas: el cultivo de queratinocitos para el tratamiento de quemaduras en la piel, el cultivo de células del limbo corneal para el tratamiento de úlceras corneales y el cultivo de condrocitos autólogos para las lesiones focales de cartílago articular.
Implante de condrocitos autólogos en suspensión
El implante de condrocitos autólogos (autologous chondrocyte implantation –ACI–) está basado en la utilización de condrocitos autólogos en suspensión(18). Los condrocitos se aíslan de una biopsia de cartílago tomada de una zona de no carga y posteriormente se cultivan e implantan en la región del cartílago dañada, donde contribuyen a su regeneración(18). Este método permite reparar con éxito defectos articulares inferiores a 10 cm2 de superficie y cuya profundidad puede llegar incluso hasta el hueso subcondral. En esta modalidad, los condrocitos se ponen en el defecto condral u osteocondral bajo un parche de periostio extraído de la tibia que se sutura al cartílago(18,19). En la mayoría de los casos (casi un 80% de los casos tratados), se produce una regeneración del cartílago que conlleva una reducción considerable del dolor y la inflamación, y una mejora sustancial en el movimiento de la articulación(20,21).
El ACI en medio líquido es una técnica que proporciona muy buenos resultados, aunque presenta algunos problemas(22). En primer lugar, se dificulta el implante de las células durante el proceder quirúrgico, ya que estas se encuentran en medio líquido, es complicado su manejo y no se pueden aplicar mediante artroscopia.
Además, hay que cubrir la zona del implante con periostio, lo que presenta 2 problemas. El primero de ellos es que la obtención de periostio requiere una cirugía mayor, al tener que acceder a la tibia, lo que incrementa la morbilidad asociada a la técnica. Por último, al ser un tejido vivo, puede dar lugar a un crecimiento hipertrófico y una posterior delaminación del implante(23).
En 1996, se empezó a aplicar en España esta técnica para el tratamiento de las lesiones de cartílago de rodilla y tobillo. Los cultivos se realizaban primero en Suecia y posteriormente en los Estados Unidos y se enviaban a España en las condiciones óptimas para la supervivencia de las células. El cultivo celular se realizaba bajo 2 indicaciones:
• Cuando por artroscopia se consideraba apropiado realizar el ACI: indicación inmediata.
• Cuando tras un tratamiento artroscópico (microfracturas, perforaciones), el paciente seguía mal y entonces como rescate se ordenaba el ACI: indicación tardía.
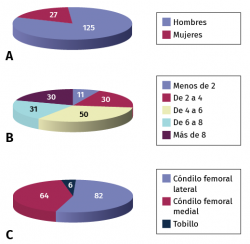
Así, desde 1996 a 2001 la casuística de la Clínica CEMTRO comprende un total de 223 biopsias tomadas, de las cuales 152 han seguido un tratamiento ACI. En total se operaron 152 pacientes cuya media de edad era de 30 años (rango: 14-56 años), de los cuales 125 eran hombres y 27 mujeres (Figura 6A). En cuanto a la profesión de estos pacientes, 101 eran deportistas y el resto tenían profesiones sedentarias.
El número de defectos tratados y su localización se muestran en las Figuras 6B y 6C. El tamaño medio del defecto era de 6,1 cm, con un rango medio de entre 1,5 y 13,5 cm.
Con respecto a las lesiones en el tobillo, en los 6 casos la localización era en el astrágalo: en 4 casos en el cuadrante superointerno y en 2 en el cuadrante superoexterno. Uno de estos casos fue el primer caso publicado en el mundo de la aplicación de la técnica en las lesiones de tobillo. En los 6 casos se practicó una osteotomía de maléolo (externo o interno), fijándolo posteriormente con un tornillo. No se utilizó inmovilización y movieron el tobillo de inmediato. No apoyaron hasta las 8-10 semanas.
Considerados globalmente, los resultados han sido muy buenos, con un seguimiento que abarca desde el año 1996, en que se implantó el primer caso, y el año 2001, fecha en que se adoptó la siguiente modalidad, hasta la actualidad (17-22 años de seguimiento). Así, el 75% de los pacientes han hecho su vida normal, incluso deporte de alta competición en alguno de los casos. Por ello, la técnica de ACI ha dado unos resultados muy satisfactorios.
Utilización de transportadores o carriers en terapia celular. Implante de condrocitos autólogos sobre membrana de colágeno
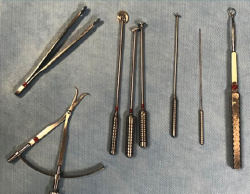
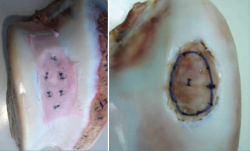
El ACI sobre un transportador (carrier o scaffold) ha supuesto un gran avance en el tratamiento de las lesiones del cartílago articular. Una de las técnicas más utilizadas en el mundo es el MACI (matrix-assisted autologous chondrocyte implantation), en la que se utiliza una membrana de colágeno I/III de origen porcino como biomaterial(24,25,26,27,28). Está basado en una modificación del procedimiento ACI, en el que se utiliza la membrana de colágeno, que actuaría como un soporte biológico sobre el que estarían integrados los condrocitos una vez cultivados(24). Con esta variación se cubriría el defecto del cartílago con la membrana en lugar de periostio (como un parche). Una ventaja de esta técnica es que se puede realizar mediante técnicas artroscópicas y, al no requerir periostio, la cirugía es más sencilla(29). Puesto que en este caso el implante se hacía con membrana, en nuestro centro se diseñó un instrumental especial para facilitar el implante del cultivo (Figura 7).
El inconveniente de esta técnica es que colocamos poca concentración celular: 1.000.000 por cm2.
Los resultados de esta variación del método han sido muy buenos y realizando el proceso por vía artroscópica se sigue alcanzando en un alto porcentaje de los casos una regeneración prácticamente total de la superficie articular mediante la formación de cartílago hialino, rico en colágeno de tipo II(25,28).
La casuística de la técnica MACI en la Clínica CEMTRO asciende a 174 pacientes desde 2001 a 2010. Los resultados de los 50 pacientes tratados con MACI en nuestro centro se publicaron en 2015(30).
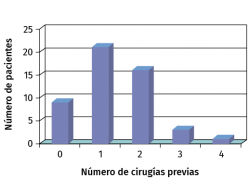
La media de edad de los pacientes era de 26 años (14-48 años). En 42 casos la lesión estaba localizada en la rodilla y en 8 en el tobillo. El diagnóstico preoperatorio era de OCD en 38 casos. De los 50 pacientes solo 9 no habían recibido ningún tratamiento quirúrgico previo. En 42 casos se había realizado una cirugía previa, siendo principalmente artroscopias o cirugías para el tratamiento de OCD (Figura 8).
El tamaño del defecto era menor de 2 cm2 en 35 casos. El éxito del implante se valoró mediante la variación del dolor antes y después de la cirugía según la escala visual analógica (EVA). Según esta escala, clasificamos el dolor del siguiente modo:
• 0-3: sin dolor ni molestias.
• 3-6: dolor que le permite realizar su vida normal pero no deporte.
• 6-10: dolor que le limita para la vida normal.
Como se recoge en la Tabla 2, se observó una mejoría significativa en el porcentaje de pacientes con dolor antes y después de la cirugía (p < 0,0001; Chi-cuadrado de Pearson).
La movilidad de los pacientes después de la cirugía era completa en todos excepto en 4 casos, que presentaban una limitación en los últimos grados de flexión. De los 50 pacientes, 32 (64%) volvieron a realizar deporte y 21 (36%) no se reincorporaron a su actividad deportiva de antes de la lesión, aunque en algún caso sí que realizaban algún tipo de deporte como piscina o bicicleta. Cuando se comparó el porcentaje de mejoría entre los pacientes que habían presentado cirugía previa y los que no, se observó que en estos segundos era del 89% frente al 69% en los operados (prueba exacta de Fisher; p = 0,1442). Aunque el resultado no es estadísticamente significativo, sí que se observa una tendencia a que el resultado sea mejor en los pacientes que no han sufrido una cirugía previa.
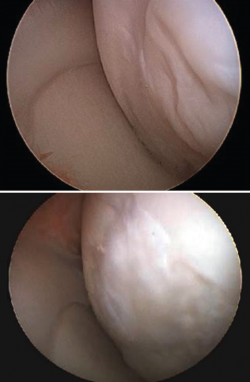
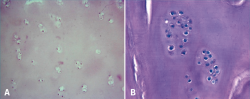
En 5 casos fue posible tomar una biopsia del tejido regenerado transcurridos 2 años después del implante. El análisis histológico muestra condrocitos rodeados de una matriz cartilaginosa, distribuidos en clusters y en algunas áreas con distribución columnar (Figura 9).
Instant CEMTRO Cell: implante de condrocitos autólogos de alta densidad
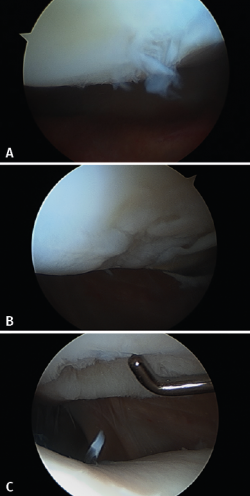
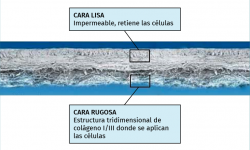
En 2008, la Clínica CEMTRO, junto con el Laboratorio Amplicel, comenzó a desarrollar un método propio de ACI sobre membrana para el tratamiento de las lesiones cartilaginosas(31). En esta técnica también se utiliza el mismo biomaterial que en la técnica MACI: la membrana de colágeno I/III de origen porcino. Dicha membrana consta de una cara rugosa permeable donde se aplican las células y que, una vez aplicadas, se pondrá en contacto con la lesión, y una cara lisa impermeable que impide que las células “escapen” de la membrana a la cavidad articular (Figura 10).
Las propiedades de la membrana de colágeno I/III que la hacen adecuada como biomaterial para el implante de condrocitos son las siguientes:
• Es un transportador mecánicamente estable.
• Es biocompatible.
• Es resistente, se puede aplicar al defecto con pegamento biológico de fibrina y admite la sutura.
• Es biodegradable y se reabsorbe en 3-6 meses.
Esta membrana, que también se utiliza en el implante MACI, no necesita el empleo de periostio y permite que pueda realizarse por artroscopia, fijando el implante mediante sutura al tejido óseo y con pegamento de fibrina para el sellado (Figura 11).
Durante la puesta a punto del método, consideramos que sería interesante realizar una modificación de la técnica MACI, ya que, aunque los resultados obtenidos eran buenos, el cartílago neoformado era más blando y presentaba menos celularidad que el original. En la técnica MACI, las células se cultivan hasta alcanzar los 20-30 millones (aproximadamente 6 semanas de cultivo), que es la cantidad que se aplica en la membrana de colágeno de dimensiones de 20 cm2, por lo que la densidad celular es de un millón de células por cm2 de lesión. Por tanto, según esta técnica, para una lesión de 2 × 2 cm2 se estarían implantado realmente 4 millones de células, “desperdiciándose” 16 millones de células (Figura 12).
Nuestra modificación se basa en aumentar la densidad celular en la membrana y así aplicar un mayor número de células. Los resultados derivados de nuestros ensayos para optimizar la densidad celular sobre la membrana mostraron que podíamos aumentar la dosis celular 5 veces(31).
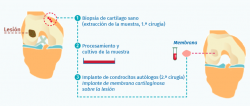
El procedimiento consistiría en: durante la cirugía de implante se mide la lesión y se recorta la membrana según el tamaño y la forma de la misma. Una vez recortada la membrana, todo el cultivo de condrocitos autólogos se aplicaría sobre ella (5 millones de condrocitos por cm2 de membrana), se esperaría el tiempo necesario (10 minutos) para su absorción y posteriormente se implantarían al paciente. De este modo, mejoraría el rendimiento de la técnica. A esta modificación la hemos denominado Instant CEMTRO Cell (ICC) o ACI de alta densidad (high density autologous chondrocyte implantation –HD-ACI–). En la Figura 13 se representa un esquema de la técnica ICC y la diferencia principal con la técnica MACI.
Procedimiento de implante de condrocitos autólogos Instant CEMTRO Cell
Nuestra propuesta de aumento de la dosis celular (5 millones de células/cm2 de lesión) mejora notablemente los resultados. En la Figura 14 se muestra el esquema del procedimiento ICC.
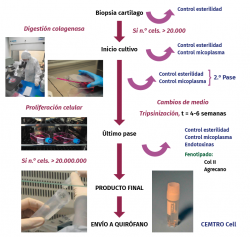
Proceso de producción
En la Figura 15 se esquematiza el proceso de cultivo de condrocitos autólogos bajo GMP. Las GMP son normas denominadas de calidad total y aseguran que todas las variables que intervienen en la producción están totalmente controladas, asegurando la calidad de todos los cultivos producidos.
Durante el proceso de producción celular se llevan a cabo los siguientes controles analíticos:
a) Test de esterilidad: se realiza en 4 fases del proceso.
b) Ensayo de micoplasma: la micoplasma es una bacteria intracelular que puede contaminar los cultivos celulares y que es difícil de detectar, puesto que no produce la turbidez del medio de cultivo. Se realiza en 3 fases del proceso de producción.
c) Ensayo de endotoxinas bacerianas: se realiza solo en un punto del proceso.
d) Fenotipado de las células: uno de los problemas que pueden surgir en los procesos de producción celular es que según se vayan realizado los pases (subcultivos) las células pueden desdiferenciarse.
En el caso de los condrocitos, su fenotipado se realiza por reacción en cadena de la polimerasa (PCR) en tiempo real para determinar la expresión de colágeno de tipo II y agrecano (genes característicos del cartílago hialino).
Aplicación clínica del implante de condrocitos de alta densidad Instant CEMTRO Cell
Desde el año 2010 hasta 2018 se han tratado con ICC un total de 245 pacientes en la Clínica CEMTRO y otros hospitales (Tabla 3) con defectos condrales en la rodilla, el tobillo y la cadera.
Es importante una buena selección de los pacientes candidatos para obtener buenos resultados con el tratamiento ICC. El ICC está indicado para la reparación de lesiones condrales y osteocondrales de grados III-IV de Outerbridge o de grado III o IV de la ICRS sintomáticas de las articulaciones. Puede tratarse más de una lesión en la misma articulación, a criterio del traumatólogo. La lesión puede deberse a un traumatismo agudo como una caída, un traumatismo repetitivo como un apoyo incorrecto sobre la rodilla durante mucho tiempo o una OCD. El ICC está indicado para todas las articulaciones sinoviales, rodilla, tobillo o cadera, pero su utilización es más frecuente en las lesiones de rodilla y de tobillo. Si la articulación presenta alguna otra lesión meniscal, luxaciones, inestabilidad o alteración del eje, debe tratarse de manera independiente y antes del implante de cartílago o en el mismo acto quirúrgico.
reaca.28171.fs1909039-figura16.png
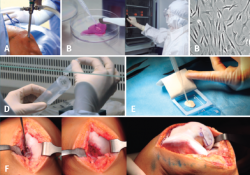
Figura 16. A: toma de biopsia; B: muestra de cartílago (tamaño 3-4 g de arroz); C: cultivo celular en sala blanca bajo normas de correcta fabricación; D: al cabo de 6 u 8 semanas se obtiene el número de células adecuado para el implante (20-30 millones, dependiendo del tamaño y el número de lesiones); E: siembra de células en la membrana (biomaterial) en el mismo quirófano, con una densidad de 5 millones de células/cm2; F: implante de la membrana con células. Sutura de la membrana.
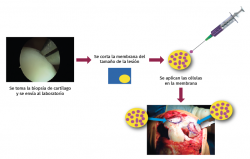
El procedimiento general de implante ICC es como sigue (Figuras 16 y 17):
• Por artroscopia, se toma una biopsia de una zona de no carga.
• La biopsia se transporta al laboratorio de terapia celular, donde se procede al cultivo celular.
• A las 4-6 semanas, se obtiene el número de células necesario, dependiendo del número de lesiones y su tamaño (5 millones de células/cm2 de lesión).
• Durante la realización del implante celular, la membrana se recorta de acuerdo con la forma y el tamaño de la lesión y todo el cultivo celular (mínimo 20 millones de células) se siembra en la membrana.
• Una vez que las células son absorbidas en la membrana, esta se implanta en el lugar de la lesión.
Pacientes con defectos condrales en la rodilla: resultados de los 50 primeros con seguimiento de 2 años
Los resultados de los 50 primeros pacientes tratados con ICC en la rodilla con un seguimiento de 2 años se han publicado recientemente(32). Los pacientes estudiados presentaban una mediana de edad de 35 años (rango: 18-49 años). Un 70% de ellos eran hombres y en el 54% de los casos el defecto condral se encontraba en la rodilla derecha. La mayoría de ellos (72%) habían sido sometidos a una cirugía previa. En el 66% de los casos el defecto era condral, en un 20% era osteocondral y en el 14% el diagnóstico era de OCD (Figura 18). Entre los pacientes con cirugías previas, en 22 casos esta cirugía tuvo lugar debido a problemas de cartílago, siendo la más frecuente las microfracturas (en un 50% de los casos con cirugías previas de cartílago).
La eficacia y la seguridad de la técnica se constataron evaluando las siguientes variables:
1. Presencia de dolor.
2. Derrame.
3. Rango de movilidad (flexión y extensión).
4. Percepción subjetiva del estado de la rodilla medido mediante la escala del International Knee Documentation Committee (IKDC).
Se utilizaron pruebas de imagen (rayos X y resonancia magnética) antes y durante el seguimiento para evaluar el resultado de los implantes (6, 12 y 24 meses).
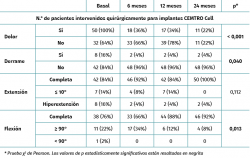
Como se puede observar en la Tabla 3, tanto el dolor como el derrame mejoraron significativamente a lo largo del seguimiento con respecto a la situación basal de los pacientes. En cuanto a la movilidad, la flexión también mejoró significativamente con respecto a la medición basal.
El cuestionario del IKDC evalúa la percepción subjetiva del paciente del estado funcional de su rodilla(33). La puntuación va de 0 a 100, siendo la puntuación más alta el mejor estado de la rodilla del paciente. Se produjo una mejoría estadísticamente significativa en la puntuación del IKDC. Los pacientes mejoraron significativamente al año y a los 2 años del tratamiento.
La mejoría en la puntuación del IKDC media con respecto a la visita basal fue de 26,3 puntos (intervalo de confianza al 95% –IC 95%– de la media: 18,2-34,4 puntos) a los 12 meses y de 31,0 puntos (IC 95% de la media: 22,9-39,0 puntos) a los 24 meses. Existe un concepto denominado diferencia mínima clínicamente importante (DMCI)(34) que indica la diferencia mínima que debe presentar el valor de un parámetro determinado en un periodo de tiempo para que el paciente lo perciba como una mejora real en dicho parámetro. En el caso de la puntuación del IKDC, se ha publicado que la DMCI a los 12 meses es de 16,7 puntos. Esto significa que en nuestro caso, en el que son mayores que la DMCI (26,3 a los 12 meses y 31 a los 24 meses), nuestros pacientes lo perciben como una mejoría clínica real.
Pacientes con defectos osteocondrales en el tobillo: resultados de los primeros pacientes con seguimiento de 2 años
Se estudiaron los primeros 52 pacientes con defectos osteocondrales en el tobillo tratados con la técnica ICC, la mayoría de ellos, 34 en total, en la Clínica CEMTRO(35). Una de las particularidades del implante de condrocitos en el tobillo es que para acceder a la lesión es necesario practicar primero una osteotomía en la mayoría de los casos. Aunque en algunos casos el defecto era más superficial, en la mayor parte, hasta en un 96% de los casos, el defecto era osteocondral. En un 35% de los pacientes la lesión es más profunda de 4 mm y es necesario emplear un injerto de hueso esponjoso tomado de la propia osteotomía, por encima del hueso subcondral, y sobre este injerto se coloca la membrana con las células.
reaca.28171.fs1909039-figura19.png
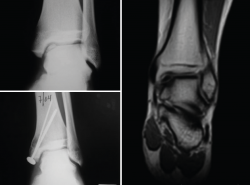
Figura 19. Regeneración del cartílago en la articulación del tobillo tras el tratamiento con Instant CEMTRO Cell (ICC). En la imagen radiológica se observa el aspecto de la lesión antes y después del tratamiento. La imagen de resonancia tomada 6 meses después del implante muestra el inicio de la regeneración del cartílago articular.
Los resultados de la evolución a corto/medio plazo de los pacientes tratados son muy satisfactorios. Tanto el dolor, medido mediante la EVA, como la funcionalidad del tobillo, evaluada por la escala de la American Orthopaedic Foot and Ankle Society (AOFAS)(36) americana, mejoran significativamente un año después del tratamiento, manteniéndose dicha mejoría al menos un año después. El porcentaje de pacientes con resultados buenos o excelentes a los 12 meses fue del 75%, incrementándose al 79,2% a los 24 meses postratamiento. Los resultados clínicos se correlacionan con los hallazgos radiológicos, que demuestran la correcta integración del injerto y la regeneración del cartílago (Figura 19).
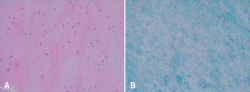
Como se ha comentado anteriormente, para acceder a la articulación es necesario practicar una osteotomía, que se reduce con material de osteosíntesis durante la cirugía del implante. Durante la retirada del material, en algunos casos es posible realizar una biopsia del tejido neoformado. En estos casos, el estudio histológico de las biopsias de estos pacientes confirma que el tejido es de naturaleza hialina y las características del tejido de la biopsia demostraron que el lugar del defecto estaba cubierto por tejido neoformado, con una naturaleza semejante al cartílago hialino con colágeno de tipo II, correspondiendo con los resultados clínicos del paciente (Figura 20).
Figuras
Figura 2. Imagen artroscópica del tejido de reparación en 2 lesiones osteocondrales del cóndilo femoral interno.
Figura 4. Imágenes artroscópicas de los grados de Outerbridge de lesión condral. A: lesión de grado I; B: lesión de grado II; C: lesión de grado III.
Figura 5. Esquema de la clasificación de las lesiones del cartílago articular según la Sociedad Internacional para la Reparación del Cartílago (ICRS). Figura adaptada del formulario de evaluación de lesiones condrales. ICRS Cartilage Injury valuation Package; 2000. Recuperado de: https://cartilage.org/content/uploads/2014/10/ICRS_evaluation.pdf.
Figura 6. Distribución por sexos de los pacientes tratados con implante de condrocitos autólogos (A), número de defectos condrales tratados (B) y localización de los mismos (C).
Figura 8. Número de cirugías previas de los pacientes tratados con MACI (matrix-assisted autologous chondrocyte implantation).
Figura 9. Tejido cartilaginoso regenerado tras un implante MACI (matrix-assisted autologous chondrocyte implantation). Se observa una celularidad limitada (A) con los condrocitos agrupados en clusters (B).
Figura 10. Membrana Chondro-Gide® (Geistlich), empleada para el implante de condrocitos Instant CEMTRO Cell (ICC).
Figura 15. Esquema del proceso de producción (cultivo celular) de condrocitos autólogos bajo las normas de correcta fabricación (GMP).
Figura 16. A: toma de biopsia; B: muestra de cartílago (tamaño 3-4 g de arroz); C: cultivo celular en sala blanca bajo normas de correcta fabricación; D: al cabo de 6 u 8 semanas se obtiene el número de células adecuado para el implante (20-30 millones, dependiendo del tamaño y el número de lesiones); E: siembra de células en la membrana (biomaterial) en el mismo quirófano, con una densidad de 5 millones de células/cm2; F: implante de la membrana con células. Sutura de la membrana.
Figura 18. Fotografía e imagen artroscópica de un ejemplo de lesión condral en el cóndilo femoral por osteocondritis disecante.
Figura 19. Regeneración del cartílago en la articulación del tobillo tras el tratamiento con Instant CEMTRO Cell (ICC). En la imagen radiológica se observa el aspecto de la lesión antes y después del tratamiento. La imagen de resonancia tomada 6 meses después del implante muestra el inicio de la regeneración del cartílago articular.
Figura 20. Se muestra el estudio histológico de un caso representativo teñido con hematoxilina eosina (A) en el que se pueden apreciar condrocitos con distribución lagunar o en parejas embebidos en una matriz rica en polisacáridos, como pone de manifiesto la tinción de azul alcián (B).
Tablas
Tabla 2. Número de implantes Instant CEMTRO Cell (ICC) realizados desde 2010. Articulaciones afectadas, número de lesiones y centros hospitalarios que han realizado esta técnica
Información del artículo
Cita bibliográfica
Autores
Isabel Guillén Vicente
Unidad de Cartílago. Clínica CEMTRO. Madrid
Unidad de Tobillo y Pie. Clínica CEMTRO. Madrid
Unidad de Rodilla. Clínica CEMTRO. Madrid
Marta Guillén Vicente
Sala de Cultivos Celulares. Amplicel
Lucía Aboli Martínez
Clínica CEMTRO. Madrid
Juan Manuel López Alcorocho
Unidad de Investigación Biomédica. Clínica CEMTRO. Madrid. España
Sala de Cultivos Celulares. Amplicel
María Dolores Pérez Pérez
Unidad de Tobillo y Pie. Clínica CEMTRO. Madrid
Medicina del Deporte. Clínica CEMTRO. Madrid
Ramón Navarro Mont
Unidad de Pie y Tobillo. Clínica CEMTRO. Madrid
Ana Belén Abenoja Lobo
Clínica CEMTRO. Madrid
Elena Rodríguez Íñigo
Clínica CEMTRO. Madrid
Pedro Guillén García
Unidad de pie y tobillo. Clínica CEMTRO. Madrid
Servicio de Traumatología. Clínica CEMTRO. Madrid
Unidad de Investigación Biomédica. Clínica CEMTRO. Madrid. España
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Hjelle K, Solheim E, Strand T, Muri R, Brittberg M. Articular cartilage defects in 1,000 knee arthroscopies. Arthroscopy. 2002;18:730-4.
-
2Widuchowski W, Widuchowski J, Trzaska T. Articular cartilage defects: study of 25,124 knee arthroscopies. Knee. 2007;14:177-82.
-
3Buckwalter JA, Mow VC, Ratcliffe A. Restoration of injured or degenerated articular cartilage. J Am Acad Orthop Surg. 1994;2:192-201.
-
4Nehrer S, Spector M, Minas T. Histologic analysis of tissue after failed cartilage repair procedures. Clin Orthop Relat Res. 1999;(365):149-62.
-
5Outerbridge RE. The etiology of chondromalacia patellae. J Bone Joint Surg Br. 1961;43-B:752-7.
-
6Slattery C, Kweon CY. Classifications in Brief: Outerbridge Classification of Chondral Lesions. Clin Orthop Relat Res. 2018;476:2101-4.
-
7Brittberg M, Winalski CS. Evaluation of cartilage injuries and repair. J Bone Joint Surg Am. 2003;85-A Suppl 2:58-69.
-
8Dwyer T, Martin CR, Kendra R, Sermer C, Chahal J, Ogilvie-Harris D, et al. Reliability and Validity of the Arthroscopic International Cartilage Repair Society Classification System: Correlation With Histological Assessment of Depth. Arthroscopy. 2017;33:1219-24.
-
9Haseltine WA. Interview: commercial translation of cell-based therapies and regenerative medicine: learning by experience. Interview by Emily Culme-Seymour. Regen Med. 2011;6:431-5.
-
10Mason C, Dunnill P. A brief definition of regenerative medicine. Regen Med. 2008;3:1-5.
-
11Daar AS, Greenwood HL. A proposed definition of regenerative medicine. J Tissue Eng Regen Med. 2007;1:179-84.
-
12Stevens A, Lowe JS. Histología Humana. Madrid: Editorial Elsevier; 2006.
-
13Purnell BA, Hines PJ. Repair and Regeneration. Science. 2017;356:1020-1.
-
14De Bari C, Dell'accio F. Cell therapy: a challenge in modern medicine. Biomed Mater Eng. 2008;18:S11-7.
-
15Närhi MO, Nordström K. Regulation of cell-based therapeutic products intended for human applications in the EU. Regen Med. 2014;9:327-51.
-
16Alici E, Blomberg P. GMP facilities for manufacturing of advanced therapy medicinal products for clinical trials: an overview for clinical researchers. Curr Gene Ther. 2010;10:508-15.
-
17Ivaskiene T, Mauricas M, Ivaska J. Hospital Exemption for Advanced Therapy Medicinal Products: Issue in Application in the European Union Member States. Curr Stem Cell Res Ther. 2017;12:45-51.
-
18Brittberg M, Lindahl A, Nilsson A, Ohlsson C, Isaksson O, Peterson L. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med. 1994;331(14):889-95.
-
19DiBartola AC, Everhart JS, Magnussen RA, Carey JL, Brophy RH, Schmitt LC, et al. Correlation between histological outcome and surgical cartilage repair technique in the knee: a meta-analysis. Knee. 2016;23(3):344-9.
-
20Brittberg M. Autologous chondrocyte implantation-technique and long term follow-up. Injury. 2008;39:S40-S49.
-
21Peterson L, Minas T, Brittberg M, Nilsson A, Sjögren-Jansson E, Lindahl A. Two- to 9-year outcome after autologous chondrocyte transplantation of the knee. Clin Orthop Relat Res. 2000;374:212-34.
-
22Dewan AK, Gibson MA, Elisseeff JH, Trice ME. Evolution of autologous chondrocyte repair and comparison to other cartilage repair techniques. Biomed Res Int. 2014;2014:272481.
-
23Kreuz PC, Steinwachs M, Erggelet C, Krause SJ, Ossendorf C, Maier D, et al. Classification of graft hypertrophy after autologous chondrocyte implantation of full-thickness chondral defects. Osteoarthritis Cartilage. 2007;15(12):1339-47.
-
24Bartlett W, Gooding CR, Carrington RW, Skinner JA, Briggs TW, Bentley G. Autologous chondrocyte implantation at the knee using a bilayer collagen membrane with bone graft. A preliminary report. J Bone Joint Surg Br. 2005;87:330-2.
-
25Bartlett W, Skinner JA, Gooding CR, Carrington RW, Flanagan AM, Briggs TW, Bentley G. Autologous chondrocyte implantation versus matrix-induced autologous chondrocyte implantation for osteochondral defects of the knee: a prospective, randomised study. J Bone Joint Surg Br. 2005;87(5):640-5.
-
26Erickson B, Fillingham Y, Hellman M, Parekh SG, Gross CE. Surgical management of large talar osteochondral defects using autologous chondrocyte implantation. Foot Ankle Surg. 2018;24:131-6.
-
27Whittaker JP, Smith G, Makwana N, Roberts S, Harrison PE, Laing P, Richardson JB. Early results of autologous chondrocyte implantation in the talus. J Bone Joint Surg Br. 2005;87(2):179-83.
-
28Kwak SK, Kern BS, Ferkel RD, Chan KW, Kasraeian S, Applegate GR. Autologous chondrocyte implantation of the ankle: 2- to 10-year results. Am J Sports Med. 2014;42:2156-64.
-
29Giannini S, Buda R, Ruffilli A, Cavallo M, Pagliazzi G, Bulzamini MC, et al. Arthroscopic autologous chondrocyte implantation in the ankle joint. Knee Surg Sports Traumatol Arthrosc. 2014;22:1311-9.
-
30Guillén-García P, Rodríguez-Iñigo E, Aráuz S, Guillén-Vicente M, Guillén-Vicente I, Caballero-Santos R, et al. Nuestra experiencia con la técnica de implante de condrocitos autólogos para el tratamiento de lesiones condrales: resultados de 50 pacientes a 2 años de seguimiento. Rev Esp Artrosc Cir Articul. 2015;22(3):120-5.
-
31Guillén-García P, Rodríguez-Íñigo E, Guillén-Vicente I, Caballero-Santos R, Guillén-Vicente M, Abelow S, et al. Increasing the Dose of Autologous Chondrocytes Improves Articular Cartilage Repair: Histological and Molecular Study in the Sheep Animal Model. Cartilage. 2014;5(2):114-22.
-
32López-Alcorocho JM, Aboli L, Guillén-Vicente I, Rodríguez-Íñigo E, Guillén-Vicente M, Fernández-Jaén TF, et al. Cartilage defect treatment using high-density autologous chondrocyte implantation: two-year follow-up. Cartilage. 2018;9(4):363-9.
-
33Grevnerts HT, Terwee CB, Kvist J. The measurement properties of the IKDC-subjective knee form. Knee Surg Sports Traumatol Arthrosc. 2015;23:3698-706.
-
34Greco NJ, Anderson AF, Mann BJ, Cole BJ, Farr J, Nissen CW, Irrgang JJ. Responsiveness of the International Knee Documentation Committee Subjective Knee Form in comparison to the Western Ontario and McMaster Universities Osteoarthritis Index, modified Cincinnati Knee Rating System, and Short Form 36 in patients with focal articular cartilage defects. Am J Sports Med. 2010;38(5):891-902.
-
35López-Alcorocho JM, Guillén-Vicente I, Rodríguez-Iñigo E, Navarro R, Caballero-Santos R, Guillén-Vicente M, et al. High-Density Autologous Chondrocyte Implantation as Treatment for Ankle Osteochondral Defects. Cartilage. 2019 Mar 17:1947603519835898.
-
36Cook JJ, Cook EA, Rosenblum BI, Landsman AS, Roukis TS. Validation of the American College of Foot and Ankle Surgeons Scoring Scales. J Foot Ankle Surg. 2011;50:420-9.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Actualización en el tratamiento de las úlceras condrales de la rodilla
- Comparación de la inyección intraarticular de plasma rico en plaquetas (PRGF®) y ácido hialurónico (Hyalone®) en el tratamiento de las lesiones condrales: estudio clínico prospectivo aleatorizado
- Microfracturas o estimulación de la médula ósea (BMS): la evolución de la técnica
- Injerto de cartílago en fresco. Indicaciones, técnica quirúrgica y evidencia científica
- Condrogénesis inducida por matrices (AMIC)
- Instant CEMTRO Cell (ICC), implante de condrocitos autólogos de alta densidad
- Regenerar el cartílago articular: perspectivas y futuro
- Cirugía de implante de condrocitos autólogos en rodilla
- Úlceras condrales de espesor completo en rótula y cóndilo femoral de rodilla
Más en PUBMED
Más en Google Scholar


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.