Neuropatías compresivas del codo
Nerve entrapment syndromes at the elbow
Resumen:
El objetivo de este manuscrito es realizar una actualización de las neuropatías compresivas del codo y el antebrazo proximal de los nervios cubital, mediano y radial, con un enfoque práctico en su diagnóstico y tratamiento.
Se describen los hallazgos fisiopatológicos que ayudan a la interpretación de los estudios electroneurofisiológicos y de los hallazgos clínicos, así como las opciones de tratamiento conservador y quirúrgico, haciendo hincapié en el detalle de la descompresión quirúrgica con ilustraciones realizadas en especímenes frescos.
Con la excepción del síndrome del túnel cubital, segunda neuropatía en frecuencia tras el síndrome del túnel del carpo, el resto de las neuropatías compresivas en la extremidad superior son infrecuentes. La base del diagnóstico de esos procesos es la sintomatología y la exploración clínica, con estudios electroneurofisiológicos frecuentemente negativos en los casos de afectación de los nervios mediano y radial, lo que puede inducir a un exceso de diagnóstico de estos procesos al realizar una interpretación inadecuada de la semiología clínica y, por ende, a un manejo inadecuado.
Las neuropatías por atrapamiento son procesos lentos, progresivos y crónicos que aparecen en puntos susceptibles a la compresión cuando los nervios atraviesan zonas superficiales y osteofibrosas que les hacen vulnerables a la lesión. El grado de lesión estructural del nervio determina la sintomatología clínica y en estadios iniciales responden con buenos resultados a medidas de tratamiento conservador, reservando la descompresión quirúrgica para aquellas situaciones de fracaso de las medidas conservadoras o en las que existe una compresión extrínseca por una solución ocupante de espacio o malformación osteoarticular.
Abstract:
The aim of this manuscript is to provide an update on ulnar, median and radial nerve entrapment neuropathies at the elbow and proximal forearm, with a practical approach to their diagnosis and treatment.
Pathophysiologic findings that aid in the interpretation of electroneurophysiologic studies and clinical findings are described, as well as conservative and surgical treatment options, with emphasis on the detail of surgical decompression with illustrations performed on fresh specimens.
With the exception of cubital tunnel syndrome, the second most common neuropathy after carpal tunnel syndrome, all other upper extremity compressive neuropathies are uncommon. The basis for the diagnosis of these processes is the symptomatology and clinical examination with electroneurophysiological studies frequently negative in cases of involvement of the median and radial nerves, which can lead to overdiagnosis of these processes with an inadequate interpretation of the clinical semiology and therefore to inadequate management.
Entrapment neuropathies are slow, progressive and chronic processes that appear in points susceptible to compression when the nerves pass through superficial and osteofibrous areas that make them vulnerable to injury. The degree of structural lesion of the nerve determines the clinical symptomatology and in initial stages respond with good results to conservative treatment measures, reserving surgical decompression for those situations of failure of conservative measures or in which there is an extrinsic compression by a space-occupying solution or osteoarticular malformation.
Introducción
Las neuropatías compresivas son los procesos patológicos más frecuentes del miembro superior, cursan con alteraciones sensitivas y/o motoras que en ocasiones producen alteración importante de la función de la extremidad afecta. Las dos entidades más comunes son el síndrome del túnel del carpo (neuropatía compresiva del nervio mediano en la muñeca) y el síndrome del túnel cubital (STCu, neuropatía compresiva del nervio cubital en el codo); el resto de las neuropatías que afectan al resto de los troncos principales y sus ramas en la extremidad superior son menos frecuentes(1). Estos síndromes compresivos son evaluados y tratados por diferentes profesionales de la medicina (médicos de atención primaria, médicos rehabilitadores, neurólogos, neurocirujanos, cirujanos plásticos y cirujanos ortopédicos). El diagnóstico puede ser sencillo si la historia, la exploración, los estudios neurofisiológicos y las pruebas de diagnóstico por imagen confirman la sospecha clínica. En las situaciones en las que las pruebas complementarias no lo corroboran, se puede caer en el error de diagnosticar como neuropatía compresiva un cuadro clínico que no lo es, así como no diagnosticarlo cuando sí existe. Por otro lado, la evaluación clínica y de los estudios neurofisiológicos ayudará a predecir el pronóstico de la recuperación.
En ocasiones, el diagnóstico no es sencillo debido a que la información por parte del paciente puede ser engañosa o confusa, o por la coexistencia de varios procesos de forma simultánea. No es infrecuente que el paciente confunda rigidez con entumecimiento (el primer síntoma no está en relación con una neuropatía y sí lo está el segundo), pueden coexistir dos procesos como la epicondilitis y la neuropatía compresiva del interóseo posterior, la compresión coincidente en el tiempo de varios nervios y, por último, un mismo nervio puede estar sujeto a un atrapamiento en diferentes niveles (double crush syndrome). Existen factores de riesgo que predisponen a la aparición de las neuropatías compresivas, como la diabetes, las neuropatías hereditarias, las anomalías anatómicas en el codo, la hipertrofia muscular y los traumatismos; sin embargo, en la mayoría de las ocasiones no se identifican causas o factores de riesgo que expliquen la aparición de estos síndromes.
Un aspecto relevante de estos procesos es la relación con la actividad laboral, pues suponen una causa frecuente de pérdida de días de trabajo. El Consejo Interterritorial del Sistema Nacional de Salud, en el Protocolo de vigilancia sanitaria específica para los/as trabajadores/as expuestos a neuropatías por presión del año 2000, define las neuropatías compresivas en el ámbito laboral como aquella lesiones nerviosas producidas por traumatismos repetidos en los nervios periféricos como consecuencia de las tareas desempeñadas en el puesto de trabajo que implican posturas forzadas mantenidas, esfuerzos o movimientos repetidos y apoyos prolongados o mantenidos. De esta descripción acerca de las neuropatías compresivas se puede deducir que difícilmente pueden ser consideradas como accidente de trabajo.
Las neuropatías por atrapamiento se producen por causas mecánicas cuando los nervios atraviesan zonas superficiales y osteofibrosas que les hacen vulnerables a la lesión. Generalmente son procesos lentos, progresivos y crónicos en los que la compresión nerviosa reiterada, permanente o intermitente, daña la vascularización nerviosa para dar lugar a continuación a un edema subperineural, desmielinización y finalmente daño axonal(2).Aunque se puede establecer una correlación entre la sintomatología y el grado de lesión desmielinizante o axonal, es raro encontrar una lesión pura, siendo lo más frecuente el hallazgo de lesiones mixtas en las que predomina un tipo de lesión histológica sobre otra. En las neuropatías compresivas, las fibras periféricas son las más vulnerables y los factores que condicionan la recuperación de la función son: el tipo de patología nerviosa, la duración de la lesión, el estado de los órganos diana y el nivel de la lesión. Si la lesión no ha producido lesiones estructurales en el nervio, la recuperación es inmediata tras la descompresión, pero puede prolongarse durante meses o llegar a ser irrecuperable si se produce un daño axonal severo.
El objetivo de este artículo es realizar un análisis de los aspectos clínicos, las pruebas de diagnóstico y el tratamiento de las neuropatías compresivas en el codo de los nervios cubital (STCu), mediano (síndrome del pronador y síndrome del interóseo anterior) y radial (síndrome del túnel radial).
Interpretación de los estudios neurofisiológicos
Ante una sintomatología sospechosa de neuropatía compresiva, es preciso confirmar que existe una lesión nerviosa, localizar el punto de atrapamiento, conocer la intensidad de la lesión y hacer un pronóstico de su recuperación. La intensidad de la lesión puede ir desde una simple desmielinización hasta una degeneración axonal. Los estudios neurofisiológicos (electroneurograma y electromiograma –EMG–) constituyen un pilar fundamental en el diagnóstico de las neuropatías compresivas. El EMG nos mostrará potenciales de fibrilación y ondas positivas en reposo cuando la lesión es axonal y el máximo esfuerzo ayudará a cuantificar la pérdida de unidades motoras. Las velocidades de conducción motora y sensitiva ayudarán a localizar el lugar de la lesión y su intensidad por el enlentecimiento de la conducción en los puntos de compresión y por la disminución de las amplitudes motoras y sensitivas en relación con la degeneración axonal.
Las neuropatías compresivas se presentan como un espectro lesional progresivo y predecible: isquemia dinámica, desmielinización y pérdida axonal. Estos estadios pueden ser diferenciados por una cuidada historia clínica, una exploración adecuada y una interpretación correcta de los estudios neurofisiológicos(3). Durante la isquemia dinámica se produce una disminución en la perfusión sanguínea del nervio en relación con el uso de la extremidad o las posiciones articulares (por ejemplo, la flexión del codo en el caso del STCu), lo que conlleva la aparición de la sintomatología que desaparecerá al cesar la causa de la isquemia y el restablecimiento del flujo sanguíneo. Estos pacientes mejorarán con medidas terapéuticas conservadoras (férulas, evitar las posiciones y los movimientos repetitivos o de esfuerzo que provocan los síntomas). Los estudios neurofisiológicos suelen ser normales, ya que las velocidades de conducción, dependientes de las fibras de conducción rápida, no se han afectado. Si la sintomatología requiere una descompresión quirúrgica, los pacientes experimentan una mejoría casi inmediata tras la cirugía. Cuando la neuropatía progresa, la isquemia causa desmielinización, produciendo un enlentecimiento de la velocidad de conducción, los síntomas son más intensos y tienden a ser constantes en lugar de intermitentes y la recuperación tras la cirugía precisa de periodos más largos (3-4 meses) hasta que se produce el proceso de remielinización. Cuando el proceso se cronifica, se produce una pérdida axonal con los siguientes cambios: los síntomas son constantes, alteración en la prueba de discriminación de dos puntos, debilidad y atrofia muscular. Los estudios neurofisiológicos muestran una disminución en la velocidad de conducción, disminución de la amplitud (reflejo del menor número de fibras funcionantes), fibrilación muscular en la fase de reposo (indica pérdida de axones motores), presencia de potenciales de acción de unidades motoras durante la fase de reclutamiento (reinervación por brotes axonales colaterales de las fibras motoras vecinas sin afectar). La recuperación después de la cirugía es mucho más prolongada, a razón de 1 milímetro por día.
Nervio cubital
El STCu es la segunda neuropatía compresiva más frecuente en la extremidad superior después del síndrome del túnel del carpo(1). Supone un reto diagnóstico, ya que frecuentemente los pacientes no acuden al médico hasta mucho tiempo después de la aparición de los síntomas y el nervio está gravemente afectado. La detección precoz de la neuropatía es crucial para obtener un buen resultado clínico y evitar la atrofia muscular irreversible. Las causas de la neuropatía cubital en el codo pueden ser: compresiones extrínsecas del nervio por tumores, consolidaciones viciosas tras fracturas y fracturas-luxaciones de codo, osteofitos e inestabilidad del nervio cubital con la flexión del codo.
Diagnóstico
Los pacientes con STCu típicamente refieren entumecimiento y hormigueo en el quinto dedo y en la mitad radial del cuarto. El comienzo de la sintomatología es intermitente y empeora por las noches, especialmente si el codo está flexionado durante el sueño. A medida que la neuropatía progresa, las parestesias son más frecuentes e incluso constantes durante el día. La flexión del codo contribuye a aumentar la sintomatología, al producir un aumento de la compresión y la tracción del nervio cubital en el canal epitrócleo-olecraneano(4). La clínica puede agravarse con actividades que requieran esfuerzo manual durante periodos prolongados. La disminución en la destreza y la pérdida de fuerza en la prensión manual y en la pinza digital implican la afectación de la musculatura intrínseca. En casos avanzados de neuropatía cubital, aparecerá atrofia de los músculos interóseos (muy evidente en el primer interóseo dorsal) y de la eminencia hipotenar, garra de los dedos cuarto y quinto, signo de Froment (hiperflexión de la articulación interfalángica al realizar la pinza) y signo de Wartenberg (abducción persistente del quinto dedo).
La exploración motora y sensitiva del nervio cubital ayuda a localizar el lugar de compresión. El STCu puede ser diferenciado del síndrome del canal de Guyon por la afectación del músculo flexor digitorum profundus (FDP) de los dedos cuarto y quinto, la afectación del territorio de la rama sensitiva dorsal en el STCu y la ausencia de estos hallazgos cuando el nervio está comprimido en el canal de Guyon.
Las maniobras de provocación incluyen la percusión (signo de Tinel), la presión directa sobre los puntos de compresión del nervio y el scratch collapse test (un área de compresión nerviosa es identificada por debilidad en la rotación externa del hombro mientras el brazo está adosado al tronco y el codo flexionado, tras la estimulación del área mediante rascado por parte del examinador)(5). La maniobra con mayor sensibilidad, alcanzando valores del 91%, es la compresión del nervio cubital en el canal epitrócleo-olecraneano mientras el codo permanece en flexión(6). La inestabilidad (subluxación o luxación) del nervio sobre el epicóndilo medial al flexionar el codo está presente en un 37% de la población sana y no siempre se acompaña de sintomatología cubital(7).
Los estudios electroneurofisiológicos proporcionarán una evaluación correcta del grado de neuropatía que padece el paciente y su utilización es recomendable, especialmente en los pacientes en los que se va a realizar una descompresión quirúrgica. Las pruebas de diagnóstico por imagen no son de uso habitual salvo si existe sospecha de compresión extrínseca o deformidad osteoarticular.
Tratamiento conservador
Como en el resto de las neuropatías compresivas, estará indicado en pacientes con síntomas leves o moderados (isquemia dinámica) en los que las alteraciones sensitivas no son constantes y la velocidad de conducción motora en el codo es mayor de 40 metros/segundo. En función de la severidad de la sintomatología y siempre que se mantengan los criterios expuestos anteriormente, el tratamiento conservador se puede prolongar hasta 2 o 3 meses antes de considerar la descompresión quirúrgica.
Se basan en medidas preventivas, tratamiento farmacológico y tratamiento rehabilitador, incluidas las técnicas intervencionistas que pueden considerarse como paso previo a la cirugía. El objetivo de las medidas preventivas es evitar los factores biomecánicos que comprimen el nervio, como apoyarse sobre la cara interna del codo, mantener una flexión mayor de 90° de forma repetida o prolongada (especialmente durante la noche), movimientos que aumentan la tensión en valgo del codo y traumatismos sobre el canal epitrócleo-olecraneano. El tratamiento farmacológico adyuvante con analgésicos orales y tópicos, antiinflamatorios no esteroideos (AINE) inhibidores de la COX-2, neuromoduladores (gabapentina y pregabalina), antidepresivos tricíclicos (amitriptilina) y opioides (tramadol) contribuye a la mejoría de los síntomas. El tratamiento rehabilitador incluye ortesis que mantengan el codo en una flexión entre 30 y 60°, terapia física (electroterapia, termoterapia y crioterapia), tratamiento manual y cinesiterápico para evitar adherencias y mejorar el movimiento del nervio y rehabilitación intervencionista (infiltración ecoguiada de un anestésico local con o sin corticoide asociado, en un punto proximal a la compresión nerviosa)(8,9).
Tratamiento quirúrgico
El tratamiento quirúrgico está sujeto a controversia, sin que exista consenso en cuanto a la mejor opción. Tampoco existe un acuerdo en si se debe asociar una descompresión del nervio cubital a nivel del canal de Guyon dada la frecuente asociación de ambos síndromes y que explicaría los fracasos tras la descompresión aislada del nervio cubital en el codo(10,11,12). En las neuropatías crónicas con lesión axonal severa, la transferencia nerviosa terminolateral (supercharged end-to-side) entre el nervio interóseo anterior (NIA) y el fascículo motor del nervio cubital al nivel de la muñeca, asociada a la descompresión nerviosa en el codo, es un procedimiento recomendable para conseguir la reinervación de la musculatura intrínseca dependiente del nervio cubital(10,13).
Selección del procedimiento quirúrgico
Los procedimientos quirúrgicos pueden ser clasificados como descompresión in situ (abierta o endoscópica) o liberación del nervio y transposición anterior (mediante epitroclectomía, transposición subcutánea, transposición transmuscular o transposición submuscular). Las ventajas teóricas de la descompresión in situ, que presenta unos resultados similares a los de la transposición anterior, comprenden una recuperación más rápida (menos disección quirúrgica y menos riesgo de complicaciones) y preservar la vascularización intrínseca y extrínseca. Esta última ventaja puede no considerarse como tal, pues se ha demostrado en estudios experimentales que se pueden movilizar y transponer grandes segmentos de nervios sin alterar el flujo sanguíneo, que se mantiene con la vascularización intrínseca en una relación diámetro:longitud de 1:41(14). Además, Nakamura et al. demostraron que no existen diferencias clínicas en los resultados obtenidos en la transposición anterior del nervio cubital, preservando y sin preservar el pedículo vascular extrínseco(15). Por otro lado, la mayor persistencia de síntomas tras la descompresión in situ frente a las cirugías primarias con transposición anterior es un argumento que se debe sopesar antes de elegir la técnica de descompresión en el STCu(16).
Técnica quirúrgica
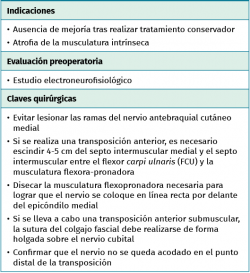
El objetivo es la descompresión del nervio cubital en todas las zonas en las que el nervio puede estar comprimido, quedando a criterio del cirujano realizar la transposición anterior del nervio o la descompresión in situ.
Colocación del paciente
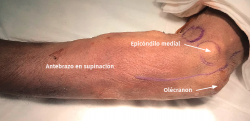
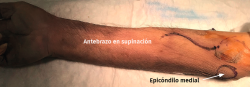
El procedimiento se realiza bajo anestesia regional o general y con manguito de isquemia en el brazo. El paciente se coloca en decúbito supino con la extremidad afectada sobre una mesa de mano. Con el hombro en rotación externa, el codo en flexión de 90° y el antebrazo en supinación, queda expuesta la zona por la que discurre el nervio cubital.
Técnica de descompresión in situ
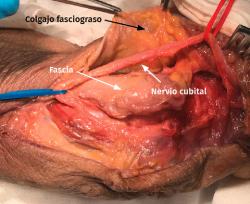
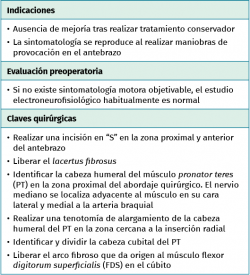
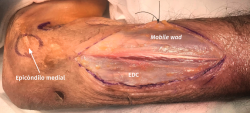
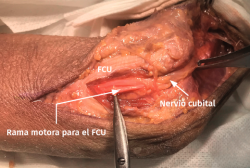
- Tras marcar el epicóndilo medial y el olécranon, se realiza una incisión curvilínea de entre 5 y 10 cm en función de la técnica de descompresión elegida, centrada en la cara posterior del epicóndilo medial (Figura 1).
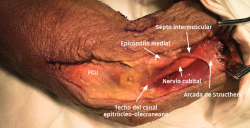
- Sobre la fascia de la musculatura epitroclear se identifican y protegen las ramas del nervio antebraquial cutáneo medial. Si resultan lesionadas inadvertidamente, el cabo proximal es aplastado con una pinza hemostática y transpuesto proximalmente en un músculo para minimizar la aparición de un neuroma doloroso.
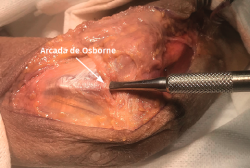
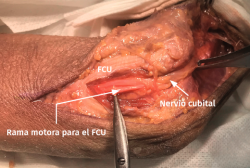
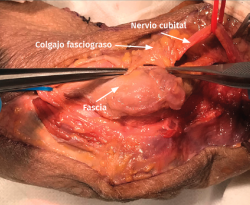
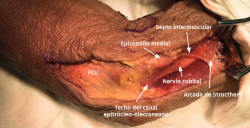
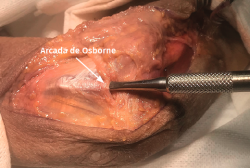
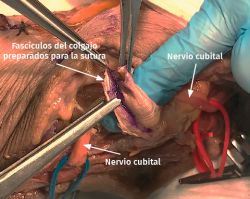
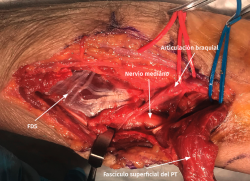
- Se identifica el nervio cubital en una zona proximal al canal epitrócleo-olecraneano por delante del músculo tríceps y por detrás del septo intermuscular medial. Descompresión de forma secuencial de todos los puntos donde el nervio puede estar comprometido (septo intermuscular medial, arcada de Struthers, techo del canal epitrócleo-olecraneano, epicóndilo medial, arcada de Osborne y los septos entre el músculo FCU hasta una distancia en la que se origina una rama motora para el músculo y la musculatura flexora-pronadora (Figuras 2, 3 y 4).
Técnica de transposición anterior
- La transposición anterior estaría indicada en los casos en los que, tras la descompresión in situ, se produce una inestabilidad del nervio con desplazamiento hacia delante saltando sobre el epicóndilo medial.
- Si se decide llevar a cabo una transposición anterior, es necesario escindir el septo intermuscular medial y el septo entre el músculo FCU y la musculatura flexora-pronadora, para conseguir que el nervio tenga un trayecto lo más rectilíneo posible por delante del epicóndilo medial. En la zona posterior al septo intermuscular se localizan estructuras venosas que es necesario coagular para evitar sangrado. La decisión de transponer la vascularización extrínseca junto al nervio consume tiempo en la disección y no ha demostrado tener ventajas clínicas, al no mejorar la vascularización intrínseca del segmento nervioso transpuesto(14,15).
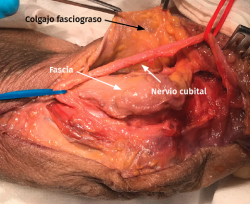
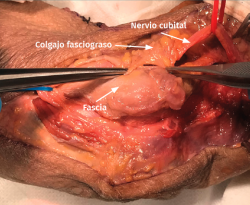
- Transposición subcutánea. Disección roma de la capa profunda del tejido celular subcutáneo y colocación del nervio por encima de la fascia de la musculatura flexora-pronadora (Figuras 5 y 6) estabilizándolo con unos puntos que fijan el tejido celular subcutáneo a la fascia muscular, comprobando que el nervio no queda comprimido.
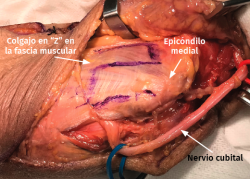
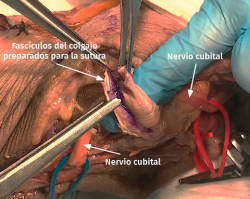
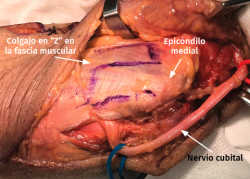
- Transposición submuscular. Se diseña y levanta un colgajo con forma de Z sobre la fascia de la musculatura flexora-pronadora para crear un lecho submuscular que albergará de una forma laxa al nervio cubital tras suturar los dos brazos del colgajo con uno o dos puntos (Figuras 7 y 8).
Cierre de la incisión
- Tras la certeza de haber liberado el nervio y de que este no está comprimido en el caso de haber realizado una transposición anterior, se suelta el manguito de isquemia y se realiza una hemostasia cuidadosa.
- La colocación de un drenaje estará en función de la hemostasia obtenida y de la preferencia del cirujano.
Medidas postoperatorias
- Vendaje compresivo que se retira a los 2 o 3 días.
- Iniciar movimientos activos del codo según la tolerancia del paciente. El tratamiento rehabilitador puede no ser necesario si el paciente moviliza activamente el codo y la recuperación de la movilidad es progresiva y satisfactoria.
- No se recomienda coger peso hasta el mes de la cirugía.
- La reincorporación laboral puede plantearse a partir de las 8 semanas de la cirugía.
Nervio mediano
El conocimiento de la anatomía del codo y del antebrazo proximal facilitará el diagnóstico diferencial entre la neuropatía compresiva del nervio mediano (síndrome del pronador) de la lesión del NIA (síndrome del interóseo anterior o de Kiloh-Nevin). La incidencia del síndrome del pronador es muy baja comparada con otras neuropatías compresivas, alcanzando solo un 1,1% de todos los síndromes por atrapamiento nervioso en la extremidad superior(1,17). Los pacientes con un síndrome del pronador presentan un síndrome del túnel del carpo asociado hasta en un 85% y requieren una descompresión del nervio mediano a nivel del codo y de la muñeca(18).
El síndrome del pronador, originalmente descrito como una compresión del nervio mediano entre las dos cabezas del músculo pronator teres (PT), también puede ser secundario a compresiones por el lacertus fibrosus (extensión fascial hacia medial del tendón del bíceps distal), por el arco aponeurótico del músculo flexor digitorum superficialis (FDS), por la arcada vascular que cruza el nervio al nivel del músculo PT, por los músculos accesorios como el de Gantzer (cabeza accesoria del músculo flexor pollicis longus –FPL–), por anomalías musculares en la zona del epicóndilo medial (origen fibroso del músculo flexor carpi radialis –FCR– o bandas fasciales del músculo brachialis) o por el ligamento de Struthers (extensión desde el proceso supracondíleo del húmero al epicóndilo medial que está presente en el 1-2% de la población)(19,20,21).
El NIA no tiene fibras sensitivas, por lo que los pacientes no manifestarán alteraciones de la sensibilidad. La parálisis del NIA habitualmente surge de forma espontánea y es limitada en el tiempo, al contrario de lo que ocurre con las neuropatías compresivas. Si no existe una compresión extrínseca, la etiología y la fisiopatología de la parálisis espontánea del NIA no están claramente descritas, pudiendo ser secundarias a una neuritis inflamatoria o a un síndrome de Parsonage-Turner (neuritis del plexo braquial o neuralgia amiotrófica) que pueden estar precedidos por procesos virales (25-55%), inmunizaciones (15%), periodos preoperatorios o alrededor de un parto (> 14%) y ejercicio físico intenso (8%)(22). En estos casos, suele haber una fase de pródromos en la que los pacientes manifiestan dolores vagos en el antebrazo antes de que se manifieste la debilidad o parálisis de los músculos dependientes del NIA.
Anatomía
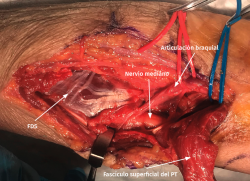
El nervio mediano surge del tronco secundario lateral del plexo braquial y está formado por contribuciones de las raíces C5 a C8 y parte de la T1. A medida que desciende por el brazo, cruza desde lateral a medial en relación con la arteria humeral y pasa por debajo del ligamento de Struthers para llegar a la fosa antecubital y situarse entre los músculos bíceps y brachialis. Continúa su trayectoria por debajo del lacertus fibrosus e inerva a los músculos PT, FCR, palmaris longus (PL) y FDS. Avanza entre las dos cabezas del músculo PT, para entrar bajo el arco fibroso del músculo FDS (la cabeza humeral se origina en el epicóndilo medial y la membrana interósea, y la cabeza radial en una amplia superficie de la cara volar y proximal del radio) a 1-2 centímetros de la cabeza profunda del músculo PT. El NIA se origina del nervio mediano a este nivel e inervará a los músculos FPL, FDP II y III, y pronator quadratus (PQ).
Diagnóstico
Los pacientes con un síndrome del pronador generalmente refieren un dolor vago en el antebrazo proximal, parestesias en el territorio del nervio mediano y dolor con la actividad. Los síntomas suelen tener un comienzo insidioso sin ningún evento desencadenante, más frecuente en mujeres alrededor de la cuarta y la quinta década de la vida, y suelen exacerbarse con los movimientos repetitivos del antebrazo y las actividades que requieren fuerza manual(18). Las alteraciones sensitivas (parestesias, disestesias o dolor) en el territorio inervado por el mediano en la mano pueden confundirlo con un síndrome del túnel del carpo, del que se diferenciará porque en este último no está afectada la rama cutánea palmar que recoge la sensibilidad de la zona palmar proximal y sí lo está en el síndrome del pronador. En el síndrome del interóseo anterior no hay alteraciones sensitivas y solo se afectarán los músculos FPL, FDP de los dedos segundo y tercero, y el PQ. Es frecuente que los pacientes refieran pérdida de fuerza en la prensión y en la pinza digital, debilidad generalizada en la extremidad superior y disminución en la destreza manual.
Las maniobras de provocación que reproducen el dolor y/o las parestesias (Tinel, scratch collapse test o el test de compresión del pronador –aparición de parestesias tras 30 segundos de presión sobre el PT en la trayectoria del nervio mediano–) pueden ayudar a localizar la zona de compresión nerviosa. El lacertus fibrosus se valora mediante la flexión resistida del codo con el antebrazo en supinación. El músculo PT se explora mediante la pronación resistida del antebrazo con el codo en extensión o preferiblemente con una flexión de 45°. El arco aponeurótico proximal del FDS mediante la flexión resistida de las articulaciones interfalángicas proximales, especialmente en el tercer dedo(18,23).
En el examen físico se observará pérdida de fuerza de los músculos dependientes del nervio mediano y/o el NIA. El FPL se explora mediante la flexión de la articulación interfalángica del pulgar, el FDS mediante la flexión de la articulación interfalángica proximal del dedo a explorar mientras el resto de los dedos están en extensión, el FDP valorando la fuerza de flexión de las articulaciones interfalángicas distales, el FCR pidiendo al paciente que realice una flexión resistida de la muñeca manteniendo los dedos flexionados y el PQ realizando pronación del antebrazo con el codo en flexión de 90°; este último puede resultar difícil de explorar cuando el PT es competente. Los pacientes con lesión del NIA serán incapaces de realizar el “signo de OK” o círculo con los dedos pulgar e índice, al no poder flexionar las articulaciones interfalángicas del pulgar (músculo FPL) e interfalángica distal del segundo dedo (músculo FDP II). Las variaciones en la inervación de la musculatura del antebrazo por anastomosis entre los nervios mediano y cubital o por inervación del FDP por el nervio cubital pueden variar la expresividad clínica de estas neuropatías(19).
En general, los estudios de diagnóstico por imagen no son de gran valor en el diagnóstico de esta neuropatía, excepto en los casos de lesiones ocupantes de espacio o en los raros casos de un proceso supracondíleo y ligamento de Struthers. La resonancia magnética (RM) puede mostrar edema en los músculos inervados por el nervio mediano o anomalías en la morfología del nervio(24).
Los estudios electroneurofisiológicos son a menudo negativos o poco concluyentes en el síndrome del pronador, mientras que confirman el diagnóstico en los casos de síndrome del interóseo anterior. La falta de evidencia en la denervación muscular no descarta la compresión proximal del nervio mediano, debido a que el número de fibras lesionadas puede no ser de suficiente magnitud para producir cambios neurofisiológicos detectables. No obstante, los estudios electroneurofisiológicos positivos en el síndrome del pronador son muy infrecuentes comparándolos con otras neuropatías compresivas(17).
La poca frecuencia de esta neuropatía, la clínica con una semiología frecuentemente vaga e imprecisa y los estudios electroneurofisiológicos negativos hacen que debamos extremar la cautela antes de realizar el diagnóstico del síndrome del pronador. La desaparición de la sintomatología tras la infiltración del nervio mediano con anestésico local ayuda en el diagnóstico y en la toma de decisiones, especialmente antes de realizar una descompresión quirúrgica.
Tratamiento conservador
Aunque no existe consenso en cuanto al tiempo que se deben mantener las medidas terapéuticas conservadoras en los casos con sintomatología leve o moderada, una duración mínima en torno a los 3 meses parece apropiada en el caso del síndrome del pronador, consiguiendo una resolución de los síntomas en 1 de cada 3 pacientes. En el caso del síndrome del interóseo anterior, el tratamiento conservador puede prolongarse más allá de los 6 meses por el elevado número de pacientes con resolución espontánea, total o parcial, hasta transcurrido un año desde la aparición del cuadro.
Las medidas preventivas están basadas en la modificación de las actividades y los gestos que empeoren la sintomatología y en la aplicación de medidas ergonómicas en el ámbito laboral, deportivo y familiar. Se recomienda el uso de teclados de ordenador partidos (split keyboards) con ligera angulación, evitar actividades de agarre y rotación para minimizar la pronación del antebrazo y aquellas que suponen flexión de codo y pinza de forma repetida. El tratamiento farmacológico no difiere del indicado en el STCu, con la excepción del síndrome del interóseo anterior, en el que se puede asociar el uso de corticoides o antivirales como el aciclovir. El tratamiento rehabilitador incluye ejercicios de estiramiento del músculo PT y flexores de la muñeca y los dedos, ortesis largas de brazo que mantengan el codo en flexión de 90° y el antebrazo en rotación neutra durante 3 o 4 semanas seguido durante otras 3 semanas solo durante la noche, terapia física para favorecer la relajación muscular y aliviar el dolor, terapia manual y cinesiterapia (mantener la movilidad articular, el trofismo y el tono muscular, la flexibilidad de los tejidos blandos y facilitar el movimiento del nervio), y rehabilitación intervencionista, de gran ayuda en los síndromes miofasciales, frecuentemente asociados a estas neuropatías(8,9).
Tratamiento quirúrgico
El objetivo del tratamiento quirúrgico del síndrome del pronador es la descompresión del nervio mediano y se considerará tras un periodo no inferior a los 3-6 meses en los que las medidas de tratamiento conservador hayan fracasado y de forma precoz en los casos de lesiones ocupantes de espacio que comprimen el nervio(19).
Técnica quirúrgica
Colocación del paciente
El paciente se coloca en decúbito supino con la extremidad afectada sobre una mesa de mano. El procedimiento se realiza bajo anestesia regional o general con el manguito de isquemia en el brazo, el codo en extensión y el antebrazo en supinación.
Técnica de liberación nerviosa
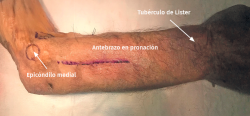
- La incisión comienza en la fosa antecubital y continúa distalmente en forma de “S” unos 10 cm (Figura 9).
- Identificación y protección del nervio antebraquial cutáneo medial y las venas de mayor calibre.
- A nivel proximal, se palpa con el dedo buscando la existencia del ligamento de Struthers, que estará presente si existe un proceso humeral supracondíleo, en cuyo caso será seccionado para eliminar un punto de posible compresión. Debe resultar fácil introducir el dedo siguiendo el nervio mediano y, si no es así, se extenderá el abordaje quirúrgico proximalmente hasta comprobar que no existe ninguna estructura compresiva sobre el nervio.
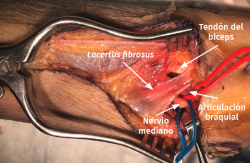
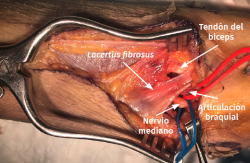
- Exposición del plano fascial del antebrazo y el brazo. Identificación y sección del lacertus fibrosus para exponer el nervio mediano y la arteria braquial (Figura 10).
- El nervio mediano se localiza medial a la arteria braquial y adyacente a la cabeza humeral (superficial) del PT para introducirse por detrás y situarse entre esta y la cabeza cubital (profunda) del músculo, que varía considerablemente en cuanto a su tamaño (entre unos milímetros y 1 o 2 cm de diámetro). Hay ocasiones en las que no existe una clara diferenciación entre las dos cabezas del PT, pero lo habitual en los casos de compresión del mediano es hallar una cabeza cubital del PT fibrosa y de consistencia dura asociada a una hipertrofia de la musculatura flexora-pronadora.
- Para conseguir una mejor visualización del nervio, se diseca la porción superficial del PT sobre la diáfisis radial en la zona distal de la incisión quirúrgica y se realiza a este nivel una Z-plastia del tendón que facilita la retracción muscular y disminuye la tensión de la cabeza superficial sobre el nervio mediano (Figura 11).
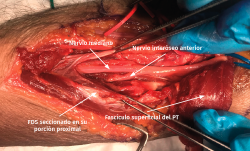
- Identificación de la cabeza cubital del PT, que se mezcla con el origen fibroso que da origen al músculo FDS en su origen cubital. Una vez expuesto el nervio, se liberará de cualquier estructura que pueda comprimirlo (p. ej., habrá que ligar los vasos sanguíneos que ejercen fuerzas compresivas sobre el nervio).
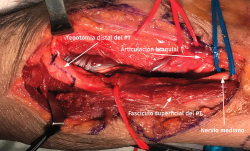
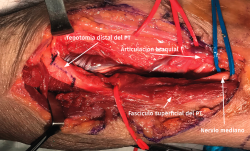
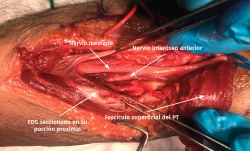
- La sección de la porción tendinosa de la cabeza cubital del PT y el origen fibroso del FDS permite descomprimir completamente el nervio mediano y visualizar el NIA cuando se dirige a inervar los músculos FPL y FDP II y III (Figuras 12 y 13).
Cierre de la incisión
- No es necesario suturar la Z-plastia de la cabeza humeral del PT.
- Se libera el manguito de isquemia y se realiza una hemostasia cuidadosa.
- La colocación de un drenaje estará en función de la hemostasia obtenida y de la preferencia del cirujano.
Medidas postoperatorias
- Vendaje compresivo y férula que se retira a los 2 o 3 días para mejorar el confort del paciente.
- Inicio de ejercicios activos de flexoextensión de codo, muñeca y dedos a partir del tercer día.
- Alrededor de las semanas 6.ª-8.ª de la cirugía se pueden reanudar las actividades habituales sin restricciones.
Nervio radial
El término “síndrome del túnel radial” fue descrito por Eversmann en 1993 para referirse a la compresión del nervio radial por el músculo supinator; posteriormente, se han descrito otras zonas alrededor del codo en las que el nervio puede estar sujeto a compresiones a lo largo del túnel radial(25,26).
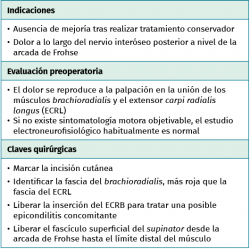
La compresión intermitente del nervio radial en el área anatómica comprendida entre la cabeza del radio y la parte distal del músculo supinator causa dolor en el codo y el antebrazo proximal, generalmente sin acompañarse de debilidad muscular y con datos electroneurofisiológicos normales, por lo que la sospecha clínica y una correcta exploración son la base del diagnóstico. La explicación de por qué un nervio motor como el interóseo posterior sometido a compresión no tiene un reflejo en los estudios neurofisiológicos se sustenta en el hecho de que estos no detectan ni la lesión de las fibras amielínicas ni de las pequeñas fibras mielínicas que son las responsables de la transmisión de los estímulos dolorosos.
La prevalencia anual de la compresión del nervio interóseo posterior es de un 0,03% y la de la rama sensitiva del nervio radial del 0,003%, una frecuencia tan pequeña comparada con la del síndrome del túnel del carpo que dificulta aún más su diagnóstico(1,27). Roquelaure et al. apuntan como factores de riesgo en el síndrome del túnel radial las actividades que precisan fuerza intensa con la muñeca en extensión y rotaciones del antebrazo(28).
Anatomía
El nervio radial está formado por la contribución de las raíces C5-T1 del plexo braquial y es una de las ramas terminales del tronco secundario posterior. Se localiza posterior a la arteria braquial al nivel de la axila y atraviesa el intervalo triangular (diáfisis humeral en la cara lateral, cabeza larga del músculo tríceps en la cara medial y músculo teres major –TM– en la base del triángulo), dando sus primeras ramas motoras al músculo tríceps antes de que se origine el nervio cutáneo posterior del brazo. Desciende por el canal de torsión del húmero para dirigirse de medial y posterior a lateral, atraviesa el septo intermuscular lateral a unos 7,5 centímetros del epicóndilo lateral del húmero y discurre entre los músculos brachialis y brachioradialis sobre el epicóndilo lateral para llegar al túnel radial. A este nivel da ramas para los músculos anconeus, brachioradialis, extensor carpi radialis longus (ECRL) y extensor carpi radialis brevis (ECRB).
Los límites del túnel radial lo forman las siguientes estructuras: la parte lateral de la cápsula articular del codo forma el suelo, los músculos brachialis y bíceps la zona medial, los músculos brachioradialis y ECRL la zona lateral y el músculo supinator la parte distal. El nervio radial, antes de penetrar entre los dos fascículos del músculo supinator, da origen a sus dos ramas terminales, la rama superficial o sensitiva (responsable de la sensibilidad de la porción cutánea dorsoradial de la muñeca y la mano) y la rama profunda o nervio interóseo posterior (rama motora para todos los músculos extensores de la muñeca y los dedos, y responsable de la propiocepción y nocicepción de parte de los estímulos dolorosos de las articulaciones radiocarpiana y radiocubital distal).
Diagnóstico
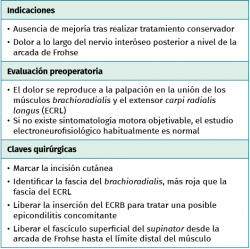
El diagnóstico del síndrome del túnel radial está sujeto a controversia, se realiza por exclusión y es dependiente de los signos y síntomas clínicos. El principal hallazgo es el dolor vago y la fatiga muscular localizados sobre el túnel radial, 3 a 5 centímetros distal al epicóndilo lateral. La sintomatología se incrementa por las noches, con la extensión del codo y con la pronación del antebrazo, posiciones que favorecen la compresión del nervio. Existen dos maniobras de provocación para exacerbar o poner de manifiesto el dolor en este síndrome. Una de ellas es la supinación resistida del antebrazo y la otra la extensión de la muñeca contra resistencia(29). La aparición de dolor al realizar la extensión resistida de la articulación metacarpofalángica del tercer dedo es una maniobra más controvertida en cuanto a su consideración como maniobra de provocación(29). Aunque la epicondilitis y el síndrome del túnel radial pueden coexistir en el tiempo y en el mismo paciente, la exploración cuidadosa y minuciosa permite diferenciar ambos procesos(26). En la epicondilitis, el dolor se localiza a nivel del epicóndilo y aumenta con la extensión resistida de la muñeca, mientras que en el síndrome del túnel radial es unos 3 a 5 centímetros distal al epicóndilo y al realizar la supinación contra resistencia del antebrazo con el codo en extensión.
Los estudios electroneurofisiológicos generalmente son negativos, ya que la compresión del nervio suele ser intermitente y solo se afectan las fibras amielínicas y las pequeñas fibras mielínicas(27). La RM en algunos casos puede mostrar edema o atrofia en la musculatura dependiente del nervio interóseo posterior, pero no es una prueba concluyente salvo en los casos de lesiones que produzcan compresión nerviosa extrínseca.
Tratamiento conservador
Las indicaciones y la duración del tratamiento conservador son similares a las del STCu y del síndrome del pronador, considerando un tiempo óptimo 2 o 3 meses antes de valorar la descompresión quirúrgica. Las excepciones son los casos en los que la causa sea una compresión extrínseca del nervio, en cuyo caso la cirugía se debe realizar lo antes posible.
Las medidas preventivas incluyen la modificación de las actividades y los gestos que empeoren el cuadro clínico, generalmente los movimientos de pronosupinación repetida del antebrazo con el codo extendido y pesos en la mano. El tratamiento farmacológico es similar al descrito para la neuropatía compresiva de los nervios cubital y mediano, si bien la utilización de relajantes musculares ayuda en la mejoría de la clínica. Las ortesis, como parte del tratamiento rehabilitador, tienen como objetivo mantener la muñeca y la mano en posición funcional hasta la resolución del cuadro, que rara vez produce una paresia de la musculatura extensora. La terapia física, la terapia manual y la cinesiterapia ayudan a aliviar el dolor, mantener la movilidad articular, preservar y mejorar el trofismo muscular y la flexibilidad de las partes blandas. Los procedimientos intervencionistas incluyen las técnicas de tratamiento para los síndromes miofasciales, frecuentemente asociados a estas neuropatías, así como las infiltraciones ecoguiadas con objetivo diagnóstico-terapéutico mediante la instilación de anestésico local y corticoide alrededor del nervio radial, proximal a la bifurcación en sus ramas sensitiva y NIA(8,9).
Tratamiento quirúrgico
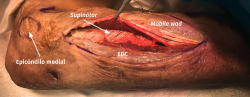
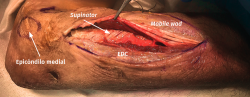
El objetivo es la descompresión del nervio radial y sus dos ramas (rama superficial e interóseo posterior) en todos los puntos donde puedan estar comprimidas a través de un abordaje anterior (Henry modificado) o cualquiera de los siguientes abordajes posteriores: Thompson (entre el músculo extensor digitorum communis –EDC– y el mobile wad –grupo muscular formado por el brachioradialis, el ECRL y el ECRB–), entre el músculo brachioradialis y los extensores de la muñeca (ECRL y ECRB) y el transmuscular brachioradialis splitting. El atrapamiento del nervio radial puede producirse en 5 lugares diferentes a lo largo del túnel radial: articulación del codo (sinovitis o artrosis), arcada vascular de Henry (ramas recurrentes de la arteria radial a nivel del cuello radial), borde proximal del músculo ECRB, arcada de Frohse (borde proximal del fascículo superficial del músculo supinator y lugar más frecuente de compresión) y el borde distal del músculo supinator(25).En los 3 primeros se afectará el nervio radial y en los 2 últimos solo el nervio interóseo posterior.
Abordajes posteriores
Colocación del paciente
El procedimiento se realiza bajo anestesia regional o general y con manguito de isquemia en el brazo. El paciente se coloca en decúbito supino con la extremidad afectada sobre una mesa de mano, el hombro en rotación interna, el codo en flexión de 90° y el antebrazo en pronación.
Técnica de liberación nerviosa
Abordaje de Thompson
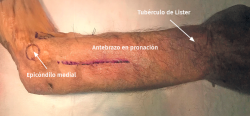
- Incisión longitudinal de 10 cm de longitud desde el epicóndilo en línea con el tubérculo de Lister (Figura 14).
- Identificación y protección del nervio cutáneo posterior antebraquial (rama del nervio radial) que se encuentra sobre la fascia del antebrazo entre los músculos brachioradialis y ECRL.
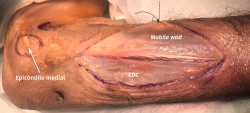
- Incisión de la fascia antebraquial entre el músculo EDC y el mobile wad (Figura 15). Este plano intermuscular se localiza con mayor facilidad en la parte más distal del abordaje, donde los tendones son más fácilmente identificables. La disección se prolonga hacia proximal, se identifica el músculo ECRB profundo al ECRL y se sigue hasta el epicóndilo, donde se desinserta. Una alternativa a la desinserción del ECRB del epicóndilo es realizar una fasciotomía circunferencial de todos los músculos epicondíleos con el objetivo de disminuir la tensión muscular y mejorar el dolor de la epicondilitis que puede estar asociado a la neuropatía compresiva del interóseo posterior(30).
- El músculo supinator se localiza con facilidad entre los músculos extensores de la muñeca y el EDC al observar sus fibras musculares que rodean el radio con un trayecto oblicuo de lateral a medial (Figura 16).
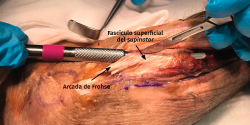
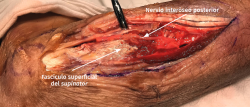
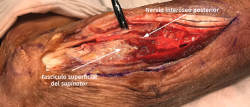
- Se identifica el nervio interóseo posterior proximal al músculo supinator y se secciona su fascículo superficial desde proximal a distal (Figuras 17 y 18).
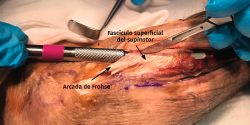
- Los vasos que cubren el nervio interóseo posterior proximal a la arcada de Frohse (arcada vascular de Henry) deben ligarse para eliminar un factor compresivo sobre el nervio.
Abordaje transmuscular brachioradialis splitting
- Incisión de 8 cm de longitud comenzando proximal a la cabeza del radio y a unos 3 cm lateral al tendón del bíceps, con el antebrazo en pronación para alejar el NIP de nuestro abordaje.
- Incisión sobre la fascia del músculo brachioradialis y disección longitudinal roma de sus fibras sobre la cabeza radial hasta identificar la grasa que cubre al nervio interóseo posterior.
- Coagulación de los vasos que atraviesan el nervio transversalmente y sección o escisión de las fibras del músculo ECRB que comprimen el nervio.
- Sección de la cabeza superficial del músculo supinator, teniendo identificado el nervio interóseo posterior durante este gesto, hasta liberar el nervio desde la porción proximal a la distal del músculo.
Abordaje entre el músculo brachioradialis y los extensores de la muñeca (ECRL y ECRB)
- La identificación preoperatoria del plano entre el brachioradialis y el ECRL se realiza pidiendo al paciente que realice una flexión contra resistencia.
- Incisión longitudinal de 10 cm a lo largo del borde posterior del brachioradialis. La fascia que cubre al ECRL es más gruesa que la del brachioradialis y ayuda a localizar el intervalo. La identificación del nervio cutáneo posterior antebraquial también facilita encontrar el plano entre ambos músculos.
- Disección roma hasta llegar a la arcada de Frohse. Si la disección no es fácil es porque no estamos en el plano correcto.
- La escisión del tendón ECRB de su inserción en el epicóndilo contribuye a tratar el dolor que pueda ser consecuencia de la epicondilitis y la sección del fascículo superior del supinator libera el nervio interóseo posterior.
- La introducción de un dedo siguiendo proximalmente el nervio radial permitirá percibir si existe compresión del nervio radial que puede precisar de una segunda incisión por encima del codo, entre los músculos brachioradialis y brachialis. Este gesto se lleva a cabo con cualquiera de los 3 abordajes posteriores descritos.
Cierre de la incisión
- Liberación del manguito de isquemia y hemostasia cuidadosa.
- La colocación de un drenaje estará en función de la hemostasia obtenida y de la preferencia del cirujano.
Medidas postoperatorias
- Vendaje compresivo durante 2 o 3 días e inicio de la movilidad activa de forma inmediata.
- La reanudación de las actividades habituales se producirá alrededor de la 8.ª semana tras la cirugía.
Abordaje anterior (Henry modificado)
Colocación del paciente
El procedimiento se realiza bajo anestesia regional o general y con manguito de isquemia en el brazo. El paciente se coloca en decúbito supino con la extremidad afectada sobre una mesa de mano, el hombro en rotación externa, el codo en extensión y el antebrazo en supinación.
Técnica de liberación nerviosa
- Incisión en “S” de unos 8-10 cm que se extiende proximal al pliegue de flexión del codo hasta la zona medial al músculo brachioradialis, evitando realizar la incisión perpendicular a nivel de la flexura del codo.
- Se protegen los nervios cutáneos y se divide la fascia a lo largo del borde medial del músculo brachioradialis que se rechaza hacia lateral y los músculos bíceps y PT hacia medial.
- En la zona proximal del abordaje, se identifica el nervio radial entre los músculos brachioradialis y brachialis y se sigue hacia distal hasta su división en la rama superficial sensitiva y el nervio interóseo posterior. Liberación del nervio de cualquier estructura que le pueda comprimir o interfiera en su movimiento.
- La rama superficial discurrirá hacia distal a lo largo de la superficie posterior del músculo brachioradialis. El nervio interóseo posterior se sigue hasta introducirse por detrás de la arcada de Frohse.
- Las estructuras fibrosas que cubren el nervio interóseo posterior, así como las fibras que dan origen al músculo ECRB y los vasos recurrentes de la arteria radial (arcada de Henry) son liberados y ligados o coagulados.
- Separación del mobile wad para visualizar el músculo supinator, división del fascículo superior desde la arcada de Frohse hasta su límite distal liberando el nervio hasta sus ramas terminales.
Cierre de la incisión
- Se libera el manguito de isquemia y se realiza una hemostasia cuidadosa.
- La colocación de un drenaje estará en función de la hemostasia obtenida y de la preferencia del cirujano.
Medidas postoperatorias
- Vendaje compresivo y férula que se retira a los 2 o 3 días para mejorar el confort del paciente.
- Inicio de ejercicios activos de flexoextensión de codo en un rango no doloroso.
- Reincorporación a las actividades habituales a las 8 semanas tras la descompresión quirúrgica.
Resultados
Los resultados del tratamiento conservador en el STCu son satisfactorios mientras exista una isquemia dinámica del nervio, pero cuando estas medidas fracasan o la sintomatología es severa, la descompresión quirúrgica obtiene unas tasas de éxito del 65 al 75%(10).
La descompresión quirúrgica el síndrome del pronador obtiene una mejoría de la sintomatología de entre un 76 y un 93% cuando el tratamiento conservador ha fracasado(18,20).
En la neuropatía compresiva del nervio radial que no responde a las medidas conservadoras, la descompresión quirúrgica obtiene buenos resultados de entre el 67 y el 92% cuando se liberan ambas ramas de nervio(26,29,31).
Conclusiones
Salvo el STCu, segunda neuropatía en frecuencia tras el síndrome del túnel del carpo, el resto de las neuropatías compresivas en la extremidad superior son infrecuentes. La base del diagnóstico de esos procesos es la sintomatología y la exploración clínica. Los estudios electroneurofisiológicos pueden ser negativos debido a que la clínica se manifiesta en un estadio inicial o a que la compresión nerviosa es intermitente, lo que produce un exceso de diagnóstico de estos procesos al realizar una interpretación inadecuada de la semiología clínica. La relación de causalidad de las neuropatías compresivas con la actividad laboral no está clara y es preciso para poder establecerla que se constaten posturas forzadas mantenidas, esfuerzos o movimientos repetidos y apoyos prolongados o mantenidos.
Las neuropatías por atrapamiento son procesos lentos, progresivos y crónicos que aparecen en puntos susceptibles a la compresión cuando los nervios atraviesan zonas superficiales y osteofibrosas que les hacen vulnerables a la lesión. El grado de lesión estructural del nervio determina la sintomatología clínica y en estadios iniciales responden con buenos resultados a medidas de tratamiento conservador, reservando la descompresión quirúrgica para aquellas situaciones de fracaso de las medidas conservadoras o en las que existe una compresión extrínseca por una solución ocupante de espacio o malformación osteoarticular.
Figuras
Figura 4. Nervio cubital liberado desde la zona proximal al canal epitrócleo-olecraneano hasta la parte proximal del músculo FCU.
Figura 10. Identificación del lacertus fibrosus que, una vez seccionado, permite una mejor visualización del nervio mediano y de la arteria braquial.
Figura 11. Disección de la porción superficial del músculo pronator teres (PT) sobre la diáfisis radial y Z-plastia del tendón que facilita la retracción muscular y disminuye la tensión de la cabeza superficial sobre el nervio mediano.
Figura 12. Exposición del nervio mediano cuando se introduce por detrás del músculo flexor digitorum superficialis (FDS) una vez se ha rechazado el fascículo superficial del músculo pronator teres (PT).
Figura 13. Liberación del nervio mediano e identificación del nervio interóseo anterior. PT: músculo pronator teres; FDS: músculo flexor digitorum superficialis.
Figura 14. Incisión longitudinal de 10 cm de longitud desde el epicóndilo en línea con el tubérculo de Lister.
Figura 15. Incisión sobre la fascia entre la mobile wad y el músculo extensor digitorum communis (EDC).
Tablas
Información del artículo
Cita bibliográfica
Autores
Fernando García de Lucas
Presidente de la SETLA
Unidad de Columna. Servicio de Cirugía Ortopédica y Traumatología. Hospital FREMAP Majadahonda. Madrid
Adela Fuentes Sanz
Unidad de Miembro Superior. Servicio de Cirugía Ortopédica y Traumatología. Hospital FREMAP Majadahonda. Madrid
Silvia Bernaldo de Quirós Ramos
Unidad de Miembro Superior. Servicio de Cirugía Ortopédica y Traumatología. Hospital FREMAP Majadahonda. Madrid
Guillermo García Ruiz-Calero
Servicio de Medicina Física y Rehabilitación. Complejo Hospitalario Universitario de Vigo. Galicia
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Latinovic R, Gulliford MC, Hughes RA. Incidence of common compressive neuropathies in primary care. J Neurol Neurosurg Psychiatry. 2006;77:263-5.
-
2Rydevik B, Lundborg G. Permeability of intraneural microvessels and perineurium following acute, graded experimental nerve compression. Scand Plast Reconstr Surg. 1977;11:179-87.
-
3Dy CJ, Mackinnon SE. Ulnar neuropathy: evaluation and management. Curr Rev Musculoskelt Med. 2016;9:178-84.
-
4James J, Sutton LG, Werner FW, Basu N, Allison MA, Palmer AK. Morphology of the cubital tunnel: an anatomical and biomechanical study with implications for treatment of ulnar nerve compression. J Hand Surg Am. 2011;36:1988-95.
-
5Cheng CJ, Mackinnon-Patterson B, Beck JL, Mackinnon SE. Scratch collapse test for evaluation of carpal and cubital tunnel syndrome. J Hand Surg Am. 2008;33:1518-24.
-
6Novak CB, Lee GW, Mackinnon SE, Lay L. Provocative testing for cubital tunnel syndrome. J Hand Surg Am. 1994;19:817-20.
-
7Calfee RP, Manske PR, Gelberman RH, Van Steyn MO, Steffen J, Goldfarb CA. Clinical assessment of the ulnar nerve at the elbow: reliability of instability testing and the association of hypermobility with clinical symptoms. J Bone Joint Surg Am. 2010;92:2801-8.
-
8Capote Kerr N, Martín del Rosario FM. Neuropatías Periféricas por atrapamiento. Diagnóstico, Valoración y Tratamiento rehabilitador. En: Martín del Rosario FM, Ruiz Fenández MA, García Bravo AM, Martín Álamo MN, Sánchez Enríquez J, Méndez Suárez JL (eds.). Manual de rehabilitación y medicina física. Sociedad Canaria de Rehabilitación y Medicina Física; 2018. pp. 891-8.
-
9Craig A, Richardson JK, Ayyangar R. Rehabilitation of Patients with Neuropathies. En: Cifu DX (ed.). Braddom’s Physical Medicine & Rehabilitation. 5th ed. Philadelphia, EE. UU.: Elsevier; 2015. pp. 907-42.
-
10Dy CJ, Mackinnon SE. Ulnar neuropathy: evaluation and management. Curr Rev Musculoskelt Med. 2016;9:178-84.
-
11Macadam SA, Gandhi R, Bezuhly M, Lefaivre KA. Simple decompression versus anterior subcutaneous and submuscular transposition of the ulnar nerve for cubital tunnel syndrome: a meta-analysis. J Hand Surg Am. 2008;33:1314-24.
-
12Zlowodzki M, Chan S, Bhandari M, Kalliainen L, Schubert W. Anterior transposition compared with simple decompression for treatment of cubital tunnel syndrome. A meta-analysis of randomized, controlled trials. J Bone Joint Surg Am. 2007;89:2591-8.
-
13Strohl A, Baron A. Severe Cubital Tunnel Syndrome: Considerations for Nerve Transfer Surgery. Curr Rev Musculoskelet Med. 2020;13(6):708-16.
-
14Maki Y, Firrell JC, Breidenbach WC. Blood flow in mobilized nerves: results in a rabbit sciatic nerve model. Plast Reconstr Surg. 1997;100:627-33.
-
15Nakamura K, Uchiyama S, Ido Y, Itsubo T, Hayashi M, Murakami H, et al. The effect of vascular pedicle preservation on blood flow and clinical outcome following ulnar nerve transposition. J Hand Surg Am. 2014;39:291-302.
-
16Aleem AW, Krogue JD, Calfee RP. Outcomes of revision surgery for cubital tunnel syndrome. J Hand Surg Am. 2014;39:2141-9.
-
17Xing SG, Tang JB. Entrapment neuropathy of the wrist, forearm, and elbow. Clin Plast Surg. 2014;41(3):561-88.
-
18El-Haj M, Ding W, Sharma K, Novak C, Mackinnon SE, Patterson JMM. Median nerve compression in the forearm: a clinical diagnosis. Hand. 2019;1-6.
-
19Strohl AB, Zelouf DS. Ulnar Tunnel Syndrome, Radial Tunnel Syndrome, Anterior Interosseous Nerve Syndrome, and Pronator Syndrome. J Am Acad Orthop Surg. 2017;25:e1-e10.
-
20Adler JA, Wolf JM. Proximal Median Nerve Compression: Pronator Syndrome. J Hand Surg Am. 2020;45(12):1157-65.
-
21Smith RV, Fisher RG. Struthers ligament: a source of median nerve compression above the elbow. Case report. J Neurosurg. 1973;38(6):778-9.
-
22Rodner CM, Tinsley BA, O’Malley MP. Pronator syndrome and anterior interosseous nerve syndrome. J Am Acad Orthop Surg. 2013;21(5):268-75.
-
23Hagert E. Clinical diagnosis and wide awake surgical treatment of proximal median nerve entrapment at the elbow: a prospective study. Hand (N Y). 2013;8(1):41-6.
-
24Dunn AJ, Salonen DC, Anastakis DJ. MR imaging findings of anterior interosseous nerve lesions. Skeletal Radiol. 2007;36(12):1155-62.
-
25Clavert P, Lutz JC, Adam P, Wolfram-Gabel R, Liverneaux P, Kahn JL. Frohse’s arcade is not the exclusive compression site of the radial nerve in its tunnel. Orthop Traumatol Surg Res. 2009;95(2):114-8.
-
26Moradi A, Ebrahimzadeh MH, Jupiter JB. Radial Tunnel Syndrome, Diagnostic and Treatment Dilemma. Arch Bone Joint Surg. 2015;3(3):156-62.
-
27Van den Ende KI, Steinmann SP. Radial Tunnel Syndrome. J Hand Surg Am. 2010;35(6):1004-6.
-
28Roquelaure Y, Raimbeau G, Saint-Cast Y, Martin YH, Pelier-Cady MC. Occupational risk factors for radial tunnel syndrome in factory workers. Chir Main. 2003;22(6):293-8.
-
29Hagert CG, Lundborg G, Hansen T. Entrapment of the posterior interosseous nerve. Scand J Plast Reconstr Surg. 1977;11(3):205-12.
-
30Manon-Matos Y, Oron A, Wolff TW. Combined Common Extensor and Supinator Aponeurotomy for the Treatment of Lateral Epicondylitis. Tech Hand Up Extrem Surg. 2013;17(3):179-81.
-
31Atroshi I, Johnsson R, Ornstein E. Radial tunnel release. Unpredictable outcome in 37 consecutive cases with a 1-5 year follow-up. Acta Orthop Scand. 1995;66(3):255-7.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Síndrome por sobreuso en el codo del paciente laboral
- Biomecánica y exploración física del codo
- Epicondilitis lateral: ¿qué sabemos?
- Manejo del codo rígido en el medio laboral
- Lesiones del tendón distal del bíceps: diagnóstico y tratamiento
- Inestabilidad traumática aguda de codo
- Fracturas de húmero distal
- Fracturas del extremo proximal de cúbito y radio
- Neuropatías compresivas del codo
- Tratamiento rehabilitador de la epicondilitis basado en la evidencia científica
- Fractura aislada de coronoides asociada a inestabilidad rotatoria posteromedial. A propósito de un caso
- Reconstrucción del tendón del bíceps distal con aloinjerto de cadáver
- <em>Degloving</em> completo del miembro superior izquierdo. Caso ilustrado
Más en Google Scholar
Más en ORCID


Revista Española de Traumatología Laboral está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.