Fisiología y mecanobiología del tejido tendinoso y muscular
Physiology and mechanobiology of tendon and muscle tissue
Resumen:
El complejo estructural que forma la unidad tendón-músculo debe ser ampliamente conocido para proporcionar un correcto diagnóstico y tratamiento a los pacientes que sufren estas lesiones.
Los tendones funcionan principalmente como elementos de transmisión de carga (tensión) de músculo a hueso. Son estructuras dinámicas que responden a la frecuencia, la magnitud, la duración y la dirección de los estímulos mecánicos o cargas. La respuesta tiene lugar a través de interacciones complejas entre las células y la matriz extracelular, que es una estructura altamente especializada.
El músculo, además de proporcionar andamiaje estructural al organismo, es el responsable de la movilidad articular mediante la contracción, permitiendo actividades complejas como andar, saltar o correr.
El objetivo de este artículo es exponer el conocimiento actual sobre la fisiología y la mecanobiología tanto del tendón como del músculo y analizar desde su arquitectura la respuesta a estímulos mecánicos, en un enfoque mecanobiológico respecto a su función.
Abstract:
The structural complex formed by the tendon-muscle junction must be widely well known in order to allow the correct diagnosis and treatment of patients with musculotendinous injuries.
Tendons mainly act as load (tension) transmission elements between muscle and bone. They are dynamic structures that respond to the frequency, magnitude, duration and direction of the mechanical stimuli or loads. This response is mediated by complex interactions between the cells and the extracellular matrix, which is a highly specialised structure.
On the other hand, the muscle affords structural scaffolding for the body, and is moreover responsible for joint mobility through contraction, -allowing complex activities such as walking, jumping or running.
The present study describes current knowledge of the physiology and mechanobiology of both tendons and muscles, and analyses their response to mechanical stimuli on the basis of their architectural features, adopting a mechanobiological approach.
Introducción
Es fundamental conocer la fisiología y la mecanobiología del tejido tendinoso y muscular para poder tratar de forma óptima las patologías en la traumatología deportiva. La complejidad de la arquitectura y la histología, asociada a la inervación y la neurotransmisión son importantes para poder comprender la mecanobiología y la mecanotransducción de las células tendinosas y las células musculares. De esto dependerá poder optimizar el funcionamiento de estos tejidos cuando están sanos y poder analizar la fisiopatología de su lesión y lograr la recuperación.
El objetivo de este artículo es exponer el conocimiento actual sobre la fisiología y la mecanobiología del tendón y del músculo. Analizar desde su arquitectura la respuesta a estímulos mecánicos, en un enfoque mecanobiológico respecto a su función.
El tendón
Los tendones son estructuras dinámicas que responden a cargas mecánicas fisiológicas o patológicas mediante interacciones complejas entre sus componentes celulares y la matriz extracelular (MEC). La mecanobiología y la mecanotransducción describen esta respuesta(1).
Arquitectura e histología
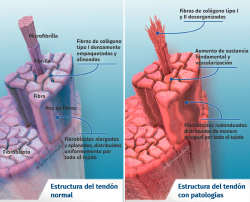
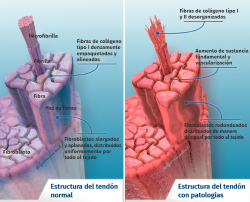
Su arquitectura presenta una organización fibrilar jerárquica, con una secuencia de moléculas de colágeno que forman fibrillas, fibras y fascículos (haces de fibras). Todo ello rodeado por una capa fibrosa denominada epitenon que reduce la fricción con el entorno. El colágeno representa el 70-80% del peso seco del tendón normal. Existe en muy diferentes formas (tipo I, III, V, IX, X, XI, XII) y con diferentes funciones estructurales, mecánicas y reparativas(1). Además, el tendón contiene proteoglicanos, como la decorina y el agrecano (que mantienen la hidratación y facilitan el deslizamiento entre moléculas), así como glicoproteínas como la tenascina C, la fibronectina y la elastina (que mantienen la estabilidad mecánica y facilitan el retorno a la condición de reposo después de cargas biológicas), todo organizado de manera alineada con el eje longitudinal del tendón (Figura 1).
La composición celular está formada por distintos tipos de células: tenocitos, condrocitos, células sinoviales, células vasculares y células madre. Las células tendinosas están intercaladas entre las fibras de colágeno y organizadas en forma de red alineadas a lo largo del eje largo de un tendón. Los tenocitos son las más importantes en número, siendo las encargadas de producir la MEC, mantener la homeostasis del tendón y reparar las lesiones. Presentan forma aplanada y están en contacto con las células vecinas mediante prolongaciones somáticas y en contacto directo con los haces de colágeno. Las prolongaciones somáticas están interconectadas entre sí mediante uniones en hendidura (conocidas como GAP) y con la MEC(1,2). Son sensibles a estímulos mecánicos y adaptan la MEC mediante cambios anabólicos o catabólicos según la magnitud, la frecuencia, la dirección y la duración de las cargas aplicadas externamente(3,4,5). El modo en que esta interacción se produce abarca un conjunto de vías existentes entre la superficie celular (tales como canales iónicos, integrinas, citoesqueleto celular, cinasas) y el núcleo de la célula para producir la respuesta biológica. Son necesarias cargas fisiológicas para mantener la homeostasis del tendón; en cambio, cargas anormalmente altas pueden llevar a la lesión, bien de manera traumática aguda o bien de forma crónica por acumulación de daño desarrollado a partir de una respuesta celulomatricial alterada(2,6).
Las otras células tendinosas son menos frecuentes y se encuentran en localizaciones especiales, como los condrocitos que están presentes en la unión tendón-hueso, las células sinoviales en el paratenon, las células vasculares presentes en los vasos nutricios de los tendones y de forma aberrante en la fisiopatología en forma de hipervascularización. También tienen importancia las células madre, que desempeñan funciones clave en la reparación, pero en la fisiopatología de la tendinopatía se ha descrito que pueden dar lugar a diferenciaciones aberrantes(7,8).
Inervación y neurotransmisión
La inervación tendinosa, aunque es definida como pobre en comparación con la del músculo, también influye en la respuesta biológica del tendón y es esencial en la regeneración de la lesión del tendón(9).
Esta inervación proviene de la unión miotendinosa y del paratenon. Las terminaciones nerviosas pueden ser ordenadas, según sus funciones, de la siguiente manera(10):
a) Mecanoceptores:
a.1) Tipo I (Ruffini), sensibles al estiramiento y la presión.
a.2) Tipo II (Vater-Pacini), sensibles a cambios de presión y de velocidad (de alargamiento, aceleraciones y deceleraciones).
a.3) Tipo III (Golgi), sensibles a los cambios de tensión.
b) Nociceptores (fibras de tipo IVa).
c) Sistema autonómico (fibras IVb), cuya principal localización está en la pared de los pequeños vasos sanguíneos.
Este sistema nervioso, además de las funciones aferentes que pueden deducirse de su propia descripción (mecanocepción, nocicepción y modulación vasomotora), presenta funciones eferentes en la proliferación celular, en la expresión de citocinas y de factores de crecimiento, en la inflamación, en la respuesta inmune y en la eferencia paradójica de las fibras aferentes nociceptivas descrita por Bayliss en 1901(11). La acción eferente se realiza a través de neurotransmisores clásicos (monoaminas, acetilcolina) y de neuropéptidos. Ambos actúan como mensajeros químicos y se almacenan en las fibras nerviosas en vesículas de diferente tamaño que, según el tamaño, responden a frecuencias de estímulo de potencial de acción diferentes. La homeostasis del tendón depende, en gran medida, del balance neuromediador que proviene de la periferia del cuerpo tendinoso(10). El balance en el que neuropéptidos y neurotransmisores clásicos tienen efectos sobre el proceso de proliferación y sobre el proceso de inflamación participa en la regeneración. Después del inicio de la lesión, las terminaciones nerviosas descritas se expanden desde la periferia al cuerpo del tendón, de forma concomitante al crecimiento vascular y la migración de células inflamatorias, y se retraen una vez reparado el tejido.
Mecanobiología y mecanotransducción
Conocer la mecanobiología de las células tendinosas es clave para comprender tanto los beneficios de las cargas controladas sobre el tejido tendinoso como la fisiopatología de su lesión. Las cargas mecánicas se trasmiten a la célula tendinosa a través de la MEC. Esta trasmisión genera fenómenos de transducción en la célula a través de estructuras transmembranosas que inician la respuesta bioquímica. La deformación de la MEC del tendón trasmite estrés de tracción, de compresión y de cizallamiento a las células; además, dentro del propio tendón se producen trasvases de fluido intersticial que también parece jugar un papel en el estímulo de las propias células. Los fenómenos de transducción celular están mediados por múltiples mecanismos y vías que incluyen el cilio primario (presente en numerosas células en mamíferos), receptores de membrana, canales iónicos, activación de ATP, cambios en el citoesqueleto celular, cambios en la expresión de los genes, etcétera. Las células tendinosas reaccionan a la carga activando los canales de calcio que aumentan la concentración de Ca++ que produce liberación de ATP, cambios en la expresión de algunos filamentos citoplasmáticos (como, por ejemplo, la actina) y aumento en la secreción de metaloproteinasas de la MEC (MMP)(12,13,14).
En el caso del tenocito, existe cada vez mas evidencia de que su estado de elasticidad/rigidez es muy importante en su relación con la MEC. La deformabilidad del tenocito depende del citoesqueleto celular (nivel de tensión basal), el cual a su vez depende del estado de tensión de la propia MEC y de las conexiones de la célula con la MEC (integrinas) y con otras células. La respuesta del tenocito a la carga del tendón (de la MEC) depende, en gran medida, del nivel de tensión basal del citoesqueleto; asimismo, existen mediadores bioquímicos que regulan las propiedades mecánicas del tenocito y de la matriz que le rodea y, por tanto, modulan su mecanosensibilidad(15). La MEC transduce la deformación externa al núcleo celular a través de proteínas integrinas y del citoesqueleto(16). El cilio primario se orienta de forma longitudinal (paralelo) a las fibras de colágeno; su papel parece importante en todo este proceso de homeostasis. Se ha observado cómo su longitud aumenta en los casos de privación de carga, efecto que puede revertirse al introducir de nuevo el efecto de la carga mecánica(17).
Existen también conexiones entre las células del epitenon y los tenocitos a través de proteínas denominadas conectinas(1). Son estructuras dinámicas que también tienen actividad mecanobiológica sobre el tenocito.
Las fuerzas generadas en el tendón (magnitud, frecuencia y duración) dependen del acondicionamiento previo del tendón (historia de carga previa: ejercicio, sobreuso, desuso) y de la composición de la MEC, que puede cambiar con la edad, el sexo, la patología previa o, simplemente, el tipo de tendón.
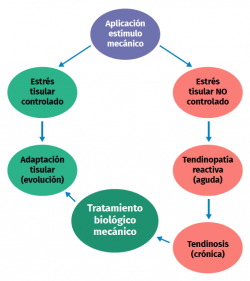
Una excesiva estimulación mecánica del tendón mediante cargas repetidas puede ocasionar daño fibrilar microscópico (Figura 2)(18,19). Al mismo tiempo, se produce una inhibición de la función celular(6,20) y, como consecuencia, una alteración de la relación celulomatricial con la siguiente secuencia:
- Rotura de fibras de colágeno.
- Hipocelularidad.
- Aumento de los niveles de metaloproteasa.
- Consiguiente apoptosis.
Los estímulos de carga excesivos dan lugar a un aumento de la producción de PGE2, un mediador inflamatorio que parece influir en la diferenciación de las células madre en células diferentes a tenocitos (produciendo así tejido diferente al tejido tendinoso)(8,21). Por otro lado, cuando el estímulo de carga es insuficiente, hay cambios en la forma y en el número de células tendinosas (tenocitos principalmente), en la cantidad de colágeno y de proteoglicanos, así como en la forma de alinearse las glicoproteínas (demostrado en colágeno de tipo I, III, agrecano, decorina y fibronectina). Además, se producen cambios en la expresión de MMP y de inhibidores de la MMP(1).
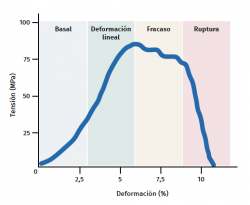
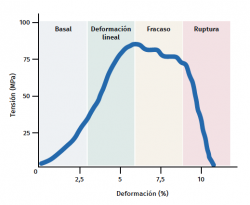
El tendón presenta un comportamiento mecánico característico y la curva de carga/deformación se representa en 4 fases (Figura 3):
a) Deformación menor del 2% (estiramiento). Corresponde a la desaparición de la ondulación típica de las fibras tendinosas. La respuesta en esta fase depende del tipo y la localización del tendón.
b) Deformación menor del 4% (región lineal). Representa el límite de la deformación fisiológica y su pendiente está indicada por el módulo de elasticidad (módulo de Young).
c) Deformación entre el 4 y el 8%. Corresponde a la aparición de microrroturas.
d) Deformación superior al 8%. Supone roturas macroscópicas o completas del tendón.
Por último, los tendones, igual que todos los tejidos biológicos, son viscoelásticos, ya que el trasvase de líquido en la MEC condiciona la respuesta mecánica. Por lo tanto, la deformación depende de la velocidad a la que se produce la carga y será mayor a velocidades bajas y al revés. A velocidades altas de carga, el tendón será mas rígido y transmite dicha carga al hueso de manera más eficaz(22).
Estrategias de tratamiento
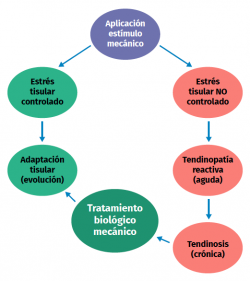
Uno de los grandes problemas es que, aunque se sabe que un nivel anormal de estimulación mecánica comporta el inicio de procesos patológicos, se desconoce cuál es el nivel adecuado de carga (magnitud, frecuencia, duración) para mantener la homeostasis normal del tendón, y tampoco conocemos cuál es el nivel preciso de carga para favorecer la reparación en el tendón patológico.
Para el tratamiento de las tendinopatías en general, uno de los tratamientos más utilizados y eficaces es el ejercicio excéntrico (Figura 4); sin embargo, no conocemos de manera precisa cómo ese tipo de carga sobre el tendón contrarresta la alteración del proceso mecanobiológico que originó la tendinopatía(23). Las otras alternativas de tratamiento se explicarán en cada una de las tendinopatías tratadas a continuación.
El músculo
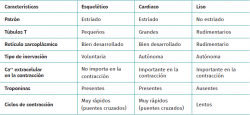
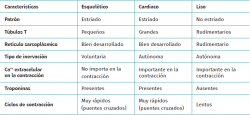
El tejido muscular se clasifica en diferentes tipos (estriado, liso y cardiaco) y cada uno de estos tiene un comportamiento particular (Tabla 1). La musculatura estriada es la responsable de función motora voluntaria. Los músculos representan entre un 40 y un 45% de la masa corporal total, siendo la fibra muscular la unidad funcional macroscópica básica del músculo.
La fuerza ejercida contra una carga externa genera tensión, produciéndose contracción muscular. Si la fuerza supera la carga hay un acortamiento de las fibras musculares (fase concéntrica), mientras que, si esta carga no es superada por la fuerza, no se produce contracción con acortamiento muscular, obteniendo así una contracción isométrica. La contracción excéntrica se produce durante la elongación del músculo y ha demostrado ser de gran utilidad en el proceso de regeneración muscular y tendinosa. Además, con la contracción excéntrica se consigue un mayor aumento de la fuerza global y de la masa muscular, en comparación con el trabajo concéntrico(24).
Arquitectura e histología
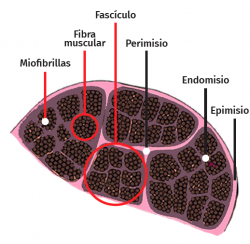
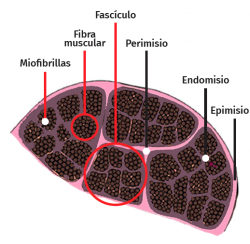
La célula muscular esquelética es multinucleada, cilíndrica y con capacidad contráctil. Cada célula está revestida por tejido conectivo formando una envoltura denominada endomisio. El perimisio es la cubierta conectiva que envuelve un grupo de células musculares formando fascículos, túneles de tejido conectivo y septos intramusculares, que atraviesan el vientre muscular y proporcionan una vía de entrada para arteriolas, vénulas y nervios. A su vez, el músculo entero está envuelto por una lámina gruesa llamada epimisio, que lo separa de los músculos circundantes. Estas capas de tejido conectivo pueden continuarse con el tejido fibroso que forma los tendones, siendo este tejido conectivo esencial para la transmisión de la fuerza generada por las células musculares al esqueleto(25) (Figura 5).
La membrana celular del miocito se denomina sarcolema y el citoplasma se conoce como sarcoplasma. En el interior de este existe una gran cantidad de haces finos de fibrillas, denominadas miofibrillas, que están constituidas a su vez por fibras aún más delgadas denominadas miofilamentos de actina y miosina. Las miofibrillas están divididas en una serie de unidades repetidas longitudinalmente llamadas sarcómeros (unidad funcional del músculo estriado).
La miosina es una proteína motora o enzima muy compleja, ya que pertenece al grupo de las enzimas que convierten el ATP en ADP + fosfatos (siendo por esta razón una ATPasa); esta actividad enzimática genera fuerzas de tracción con gasto energético (ATP), moviéndose por el filamento de actina hacia el extremo mas polarizado.
La actina es una proteína globular que, a través de la polimerización (unión de las moléculas de G-actina), conforma el filamento de actina (F-actina). Hay 2 tipos, alfa y beta, la primera abunda en el músculo estriado y la segunda en la mayoría de las células animales. Los filamentos miden 7 mm; por ello, también se denominan microfilamentos. El mecanismo de incremento y acortamiento de la longitud de los filamentos de actina se produce por polimerización; en un extremo del filamento predomina la polimerización (adición de nuevas moléculas de G-actina) y en el otro despolarización.
Los túbulos T y el retículo sarcoplásmico están formados por un desarrollado sistema de membranas existente en el músculo estriado. Los túbulos T son prolongaciones del sarcolema, transversales a su superficie, también conocidos como túbulos transversales por esta razón. Tiene como función transmitir el impulso eléctrico hacia el interior de la célula, más específicamente a la membrana del retículo sarcoplásmico.
El retículo sarcoplásmico es una organela similar al retículo endoplásmico, cuya principal función es producir proteínas, pero, a diferencia de este, el retículo sarcoplásmico es responsable por almacenar calcio intracelular, regulando estas concentraciones a través de bombas de iones de Ca++ presentes en su membrana que utilizan gasto de ATP como combustible para absorber Ca++ hacia su interior, dando paso al proceso de relajación-contracción del músculo estriado.
La célula satélite, por su localización periférica, se encuentra entre la lámina basal, siendo rodeada por esta, y, por fuera del sarcolema, permanece en reposo hasta que un estímulo externo la activa (ejercicio físico)(26). Una vez activadas son fácilmente identificables morfológicamente, como abultamiento en la fibra muscular y la presencia de procesos citoplasmáticos que se prolongan hacia uno o ambos polos celulares, representando el incremento en su actividad mitótica(25). Las células satélites protagonizan el proceso regenerativo muscular. La actividad de las células satélite, en respuesta a diversos estímulos, está relacionada con la activación sin proliferación, proliferación sin diferenciación posterior o proliferación y diferenciación (dependiendo de los estímulos relacionados con procesos de hipertrofia o regeneración)(25).
Inervación y neurotransmisión
Como se comentó anteriormente, el estímulo procedente de las fibras nerviosas motoras al llegar el potencial de acción por los axones de los nervios motores libera acetilcolina en la sinapsis, estimulando la liberación del Ca++ desde el retículo sarcoplásmico y estimulando así la fibra muscular, con la consecuente excitación de esta y, por lo tanto, activando la contracción muscular(26,27).
Las fibras musculares están inervadas por ramificaciones de los axones de las fibras nerviosas motoras (neurofibrillas), provenientes de la médula espinal. El conjunto axón-fibras musculares es denominado unidad motora.
Existen 3 tipos de unidades motoras:
- Tipo I (lentas y resistentes a la fatiga): las fibras de tipo I son caracterizadas por una alta densidad mitocondrial y alta actividad de enzimas oxidativas, están acompañadas de producción energética aeróbica, rica vascularización capilar, alta concentración de mioglobina y baja actividad de miosina-ATPasa(28). Son capaces de generar tensiones discretas durante periodos largos de tiempo sin fatigarse; además, la fuerza que generan aumenta y disminuye de forma lenta. En estas unidades las motoneuronas son de menor tamaño, con menor velocidad de conducción y menor umbral de excitación con respecto a los otros tipos. Son característicos en deportes de resistencia (maratón, ultratrail y ciclismo).
- Tipo IIA (rápidas y resistentes a la fatiga): combinan propiedades de I y IIX/IIB, ya que tienen capacidad aeróbica suficiente para resistir a la fatiga durante varios minutos.
- Tipo IIX/IIB (rápidas y fatigables): las fibras de tipo IIX están presentes en el ser humano, mientras que las fibras de tipo IIB están presentes exclusivamente en músculos de animales. Se benefician de producción energética anaeróbica y les caracteriza una baja densidad mitocondrial. Su principal vía de obtención de energía es la glicolítica, tienen alta actividad de CK, pobre vascularización capilar, baja concentración de mioglobina y alta actividad de miosina-ATPasa(28). Poseen fibras musculares de tamaño grande que desarrollan mayor fuerza en cortos periodos de tiempo por emplear el metabolismo anaerobio. Sus motoneuronas son grandes, con elevadas velocidades de conducción y umbral de excitación(29). Son características en deportes de fuerza.
Mecanobiología y mecanotransducción
Al igual que ocurre en el tendón y teniendo presente su íntima asociación con el músculo, entender estos eventos es imprescindible para una mejor comprensión y aplicación de la evidencia actual en el tratamiento de lesiones musculares o miotendinosas.
La mecanotransducción es la deformación celular al percibir su entorno y adaptarse a él mediante cambios en el citoesqueleto, que son transmitidos al núcleo, los cuales varían desde un simple cambio en la forma celular hasta la expresión de nuevas proteínas. Procesos como la presencia de hiperplasias o displasias y la remodelación son ejemplos claros de este mecanismo. Este campo de estudio es relativamente nuevo y ha permitido establecer estas relaciones a través de investigaciones multidisciplinarias, pero todavía falta profundizar e integrar muchos elementos involucrados.
El modo de carga que viene a la mente más rápidamente en el músculo es la carga inducida por la generación de fuerza activa. La adaptabilidad del músculo esquelético a los cambios en el entorno mecánico ha sido bien caracterizada en el ámbito de los tejidos y del sistema, pero los mecanismos a través de los cuales las señales mecánicas se transducen a señales químicas que influyen en el crecimiento y el metabolismo de los músculos permanecen en gran parte sin identificar. Sin embargo, varios hallazgos han sugerido que la transducción de señales mecánicas en el músculo puede ocurrir a través de vías de señalización que se comparten con el factor de crecimiento similar a la insulina (IGF)-I. La participación de la señalización mediada por IGF-I para la transducción de señales mecánicas en el músculo fue sugerida originalmente por las siguientes observaciones(30):
- El músculo libera IGF-I en la estimulación mecánica.
- IGF-I es un agente potente para promover el crecimiento muscular y afectar el fenotipo.
- IGF puede funcionar como una hormona autocrina en el músculo.
La evidencia muestra que al menos 2 vías de señalización resultantes de la unión de IGF-I pueden influir en la adaptación y el crecimiento muscular. Se ha demostrado que la señalización a través de la calcineurina/factor nuclear de la vía de las células T activadas influye poderosamente en la promoción del fenotipo lento/tipo I en el músculo y puede aumentar la masa muscular. Esta vía puede activarse por la estimulación neural del músculo; aún queda por investigar si la activación neural de la vía es independiente de la activación mecánica o de la señalización mediada por IGF-I(30).
La tensión general no regula de forma única el tamaño de la fibra muscular. La transmisión de la fuerza, a través de vías distintas de las uniones miotendinosas, puede contribuir a las discrepancias informadas: debido a la heterogeneidad en serie sustancial de las longitudes de los sarcómeros dentro de las fibras musculares que crean variaciones locales en los estímulos mecánicos para la adaptación. Para la fibra muscular única, la señalización mecánica es bastante diferente de la condición in vivo o in vitro. La eliminación de los efectos de tracción y cizallamiento de los tejidos vecinos (incluso del músculo antagonista) modifica o elimina los estímulos mecánicos para la adaptación(31).
El aparato contráctil es la estructura más destacada de una fibra muscular y puede ser un excelente marcador de la deformación celular. Las matrices interdigitales de filamentos gruesos y delgados están rígidamente inmovilizadas por los discos M y Z, respectivamente, y los filamentos gruesos están atados por titina al disco Z. A medida que la fibra se alarga, los filamentos se deslizan entre sí.
El modelo del deslizamiento propone que los filamentos finos se mueven sobre los gruesos. Este desplazamiento es posible por la unión entre las cabezas de miosina con puntos activos o complementarios de la molécula de actina. La formación de uniones, a través de los puentes cruzados, entre la actina y la miosina que se activan y desactivan cíclicamente constituye el proceso que conduce al acortamiento del músculo durante la contracción(27).
El estímulo recibido a través de las fibras nerviosas motoras generará un potencial de acción muscular, extendiéndose a lo largo de toda la membrana o sarcolema.
La contracción muscular se produce por deslizamiento de los filamentos finos y gruesos (actina y miosina II, respectivamente) entre sí. Esta interdigitación de los filamentos produce una disminución de longitud del sarcómero.
La fuerza máxima generada por una contracción es directamente proporcional a la sección transversal del músculo.
La disposición de las fibras del músculo con respecto a su eje longitudinal divide al músculo en:
- Fusiformes: fibras paralelas al eje longitudinal del músculo.
- Peniformes: las fibras forman un ángulo con el eje longitudinal del músculo.
El músculo peniforme produce mayor fuerza, dado que hay mayor número de células en su sección.
Tipos de lesión muscular y clasificación
Las lesiones musculares son muy frecuentes en el deporte. En concreto, en el fútbol(32), el rugby(33) o el atletismo(34) se registran incidencias superiores al 30%.
Por el mecanismo lesivo, se clasifican en indirectas y directas. Las directas más frecuentemente causadas por traumatismos contusos y las indirectas producidas sobre todo en la fase de contracción excéntrica(26).
La localización anatómica de la lesión en el músculo es tan importante como su extensión, debido a que la cantidad de tejido conectivo afectado (miofascial, miotendinoso, intramuscular) condiciona el tiempo de recuperación y el retorno a la práctica deportiva(35,36). Los músculos biarticulares (bíceps femoral, gastrocnemio y recto femoral) también son más susceptibles de lesión por mecanismo indirecto en la fase excéntrica, debido a sus características biomecánicas con incrementos tensionales que exceden a la resistencia muscular. Cuando el mecanismo es por incremento de la contracción excéntrica, la lesión es más frecuente en la unión miotendinosa(26,27), así como la fatiga y el fallo de los mecanismos regeneradores y reparadores celulares tras la rotura.
Las fibras musculares inviables son eliminadas por macrófagos tisulares, activación de la fosfolipasa A2, incremento de las proteasas, prostaglandinas y disminución de la creatina cinasa. Se acumula el calcio intracelular por fallo del retículo sarcoplásmico, con un aumento de la temperatura y de los radicales libres de oxígeno, y la consiguiente reducción del pH(37).
Se produce así una doble respuesta reparadora:
- Las células satélites se diferencian en mioblastos y se fusionan para formar nuevas fibras musculares (regeneración).
- Se crea una cantidad variable de tejido conjuntivo no especializado (cicatrización).
En general, cuando el músculo tiene un peso superior a 1,5 g, la cicatrización excede y ahoga a la regeneración muscular. La carga óptima es aquella que se aplica y que genera una ligera sensación de molestia a la hora de realizar la actividad y después de esta. Sin el estímulo de carga no hay regeneración de los tejidos; la carga baja que puede representar el reposo hace que la lesión no vaya a más, pero no mejora los procesos de adaptación. Una alta carga repetida –por ejemplo, hacer más kilómetros de lo habitual corriendo– enlentece la regeneración y provoca adaptaciones del sistema nervioso que pueden llevar a tener más dolor y fenómenos de evitación, así como patrones de movimiento compensatorios(38,39,40,41).
Existen diversos sistemas de clasificación para las lesiones musculoesqueléticas.
Tradicionalmente, se han clasificado en un sistema basado en 3 grados de rotura: leve, parcial o completo. Este sistema proporciona poca información sobre el pronóstico y el tratamiento a seguir.
En los últimos años se han incorporado otros sistemas de clasificación, como el de consenso de Múnich o la clasificación de Chan et al.(35,36). La dificultad principal de estas clasificaciones es la falta de objetividad en los tiempos de recuperación o de retorno al deporte y tratamiento.
Finalmente, la British Athletics Muscle Injury Classification propone un nuevo sistema basándose en el pronóstico y la decisión terapéutica(35). Se clasifican las lesiones de 0 a 4 según las características observadas en la resonancia magnética y con un sufijo “a, b, c” dependiendo de su localización: miofascial, musculoesquelética o intratendinosa. Fue desarrollada para clasificar lesiones en los músculos isquiotibilaes y basándose en la literatura de este campo, pero tiene potencial para ser extrapolada al resto de las lesiones musculares, al igual que la guía del Fútbol Club Barcelona para el tratamiento de las lesiones musculares FCB Muscle Injury Guide: Prevention of and Return to Play from Muscle Injuries(36). Sin embargo, se necesita una mayor precisión diagnóstica, un sistema que proporcione más detalle sobre el tratamiento rehabilitador y una escala de tiempo más definida para aplicarlo en ámbitos tan exigentes como es el deporte de élite.
Estrategias de tratamiento
Determinar el tipo de programa de rehabilitación que promueva de manera más efectiva la recuperación funcional y del tejido muscular es esencial para minimizar el riesgo de una nueva lesión y optimizar el rendimiento del atleta.
En la fase aguda inicial (3-5 días desde la lesión), el tratamiento con reducción de la actividad, hielo, compresión y elevación tiene como objetivo controlar la fase inflamatoria. La activación funcional precoz ha demostrado aumentar la vascularización, mejorar la regeneración de fibras musculares, evitar cicatrices fibrosas y recuperar con mayor facilidad las características viscoelásticas y contráctiles del músculo(38,39).
Se ha demostrado que los ejercicios de control neuromuscular(40,41) y el entrenamiento excéntrico(38) reducen la probabilidad de lesión del tendón de los isquiotibiales y muchos recomiendan que se incluyan como parte de la rehabilitación después de una lesión por esfuerzo agudo. Se cree que el fortalecimiento excéntrico, en particular, aumenta la distensibilidad de la serie de los músculos y permite longitudes operativas más largas, lo que puede contrarrestar los efectos del tejido cicatricial. Se debe tener presente que, tras el regreso a la práctica deportiva, se debería seguir un programa de readaptación progresivo para prevenir y disminuir el riesgo de sufrir una nueva lesión(39).
Conclusiones
La arquitectura y la histología del tejido tendinoso y muscular es compleja y, en conjunto con la inervación y la neurotransmisión, nos permiten comprender la mecanobiología de estos tejidos. Su conocimiento es la piedra angular sobre la que debe pivotar un correcto y detallado diagnóstico, así como un minucioso, multidisciplinario y personalizado tratamiento.
Figuras
Figura 3. Esquema gráfico del comportamiento mecánico del tendón durante el estímulo mecánico. Adaptado por F. Abat de Chicharro et al. Fisiología del ejercicio. Madrid: Ed. Médica Panamericana; 2006(29).
Figura 4. Ejemplo de ejercicio con maquinaria isoinercial de tipo multigym para producir sobrecarga excéntrica en la musculatura de las extremidades inferiores.
Tablas
Información del artículo
Cita bibliográfica
Autores
Ferrán Abat González
Traumatólogo deportivo, ReSport Clinic Barcelona.
Universidad Blanquerna, Ramon Llull. Barcelona
Servicio de Cirugía Ortopédica y Traumatología. Hospital de la Santa Creu i Sant Pau. Universitat Autònoma de Barcelona
Antonio Turmo Garuz
Centro de Alto Rendimiento de Sant Cugat. Universidad de Barcelona
Jocelio Campos Moraes
ReSport Clinic Barcelona. Universidad Blanquerna, Ramon Llull. Barcelona
Bruno Capurro Soler
ReSport Clinic Barcelona. Universidad Blanquerna, Ramón Llull. Barcelona
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de interés.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Wang JH, Guo Q, Li B. Tendon biomechanics and mechanobiology - a minireview of basic concepts and recent advancements. J Hand Ther. 2012 Apr-Jun;25(2):133-40.
-
2Magnusson SP, Langberg H, Kjaer M. The pathogenesis of tendinopathy: balancing the response to loading. Nat Rev Rheumatol. 2010 May;6(5):262-8.
-
3Banes AJ, Tsuzaki M, Yamamoto J, et al. Mechanoreception at the cellular level: the detection, interpretation, and diversity of responses to mechanical signals. Biochem Cell Biol. 1995 Jul-Aug;73(7-8):349-65.
-
4Lavagnino M, Arnoczky SP, Tian T, Vaupel Z. Effect of amplitude and frequency of cyclic tensile strain on the inhibition of MMP-1 mRNA expression in tendon cells: an in vitro study. Connect Tissue Res. 2003;44(3-4):181-7.
-
5Screen HR, Shelton JC, Bader DL, Lee DA. Cyclic tensile strain upregulates collagen synthesis in isolated tendon fascicles. Biochem Biophys Res Commun. 2005 Oct 21;336(2):424-9.
-
6Arnoczky SP, Lavagnino M, Egerbacher M. The mechanobiological aetiopathogenesis of tendinopathy: is it the over-stimulation or the under-stimulation of tendon cells? Int J Exp Pathol. 2007 Aug;88(4):217-26.
-
7Zhang J, Wang JH. Mechanobiological response of tendon stem cells: implications of tendon homeostasis and pathogenesis of tendinopathy. J Orthop Res. 2010 May;28(5):639-43.
-
8Zhang J, Wang JH. Production of PGE(2) increases in tendons subjected to repetitive mechanical loading and induces differentiation of tendon stem cells into non-tenocytes. J Orthop Res. 2010 Feb;28(2):198-203.
-
9Ackermann PW, Salo PT, Hart DA. Neuronal pathways in tendon healing. Front Biosci. 2009 Jun 1;14:5165-87.
-
10Ackermann PW. Neuronal regulation of tendon homeostasis. Int J Exp Pathol. 2013 Aug;94(4):271-86.
-
11Bayliss WM. On the origin from the spinal cord of the vaso-dilator fibres of the hind-limb, and on the nature of these fibres. J Physiol. 1901 Feb 28;26(3-4):173-209.
-
12Banes AJ, Tsuzaki M, Yamamoto J, et al. Mechanoreception at the cellular level: the detection, interpretation, and diversity of responses to mechanical signals. Biochem Cell Biol. 1995 Jul-Aug;73(7-8):349-65.
-
13Magra M, Hughes S, El Haj AJ, Maffulli N. VOCCs and TREK-1 ion channel expression in human tenocytes. Am J Physiol Cell Physiol. 2007 Mar;292(3):C1053-60.
-
14Archambault JM, Elfervig-Wall MK, Tsuzaki M, Herzog W, Banes AJ. Rabbit tendon cells produce MMP-3 in response to fluid flow without significant calcium transients. J Biomech. 2002 Mar;35(3):303-9.
-
15Wilusz RE, Sanchez-Adams J, Guilak F. The structure and function of the pericellular matrix of articular cartilage. Matrix Biol. 2014 Oct;39:25-32.
-
16Jones E, Legerlotz K, Riley G. Mechanical regulation of integrins in human tenocytes in collagen and fibrin matrices. Bone Joint J. 2014; 96-B:161.
-
17Lavagnino M, Arnoczky SP, Gardner K. In situ deflection of tendon cell-cilia in response to tensile loading: an in vitro study. J Orthop Res. 2011 Jun;29(6):925-30.
-
18Docking SI, Daffy J, van Schie HT, Cook JL. Tendon structure changes after maximal exercise in the Thoroughbred horse: use of ultrasound tissue characterisation to detect in vivo tendon response. Vet J. 2012 Dec;194(3):338-42.
-
19Andarawis-Puri N, Sereysky JB, Jepsen KJ, Flatow EL. The relationships between cyclic fatigue loading, changes in initial mechanical properties, and the in vivo temporal mechanical response of the rat patellar tendon. J Biomech. 2012 Jan 3;45(1):59-65.
-
20Egerbacher M, Arnoczky SP, Caballero O, Lavagnino M, Gardner KL. Loss of homeostatic tension induces apoptosis in tendon cells: an in vitro study. Clin Orthop Relat Res. 2008 Jul;466(7):1562-8.
-
21Wang JH, Jia F, Yang G, et al. Cyclic mechanical stretching of human tendon fibroblasts increases the production of prostaglandin E2 and levels of cyclooxygenase expression: a novel in vitro model study. Connect Tissue Res. 2003;44(3-4):128-33.
-
22Wang JH. Mechanobiology of tendon. J Biomech. 2006;39(9):1563-82.
-
23Abat F, Alfredson H, Cucchiarini M, et al. Current trends in tendinopathy: consensus of the ESSKA basic science committee. Part I: biology, biomechanics, anatomy and an exercise-based approach. J Exp Orthop. 2017 Dec;4(1):18.
-
24Roig M, O'Brien K, Kirk G, et al. The effects of eccentric versus concentric resistance training on muscle strength and mass in healthy adults: a systematic review with meta-analysis. Br J Sports Med. 2009 Aug;43(8):556-68.
-
25Mauro A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 1961 Feb;9(2):493-5.
-
26Järvinen TA, Järvinen TL, Kääriäinen M, et al. Muscle injuries: optimising recovery. Best Pract Res Clin Rheumatol. 2007 Apr;21(2):317-31.
-
27Best TM, Hunter KD. Muscle injury and repair. Phys Med Rehabil Clin N Am. 2000 May;11(2):251-66.
-
28Casey A, Greenhaff PL. Does Dietary Creatine Supplementation Play a Role in Skeletal Muscle Metabolism and Performance? Am J Clin Nutr. 2000 Aug;72(2 Suppl):607S-17S.
-
29Chicharro J, Fernández A. Fisiología del ejercicio. Madrid: Ed. Médica Panamericana; 2006.
-
30Tidball JG. Mechanical signal transduction in skeletal muscle growth and adaptation. J Appl Physiol (1985). 2005 May;98(5):1900-8.
-
31Huijing PA, Jaspers RT. Adaptation of muscle size and myofascial force transmission: a review and some new experimental results. Scand J Med Sci Sports. 2005 Dec;15(6):349-80.
-
32Ekstrand J, Hägglund M, Waldén M. Epidemiology of muscle injuries in professional football (soccer). Am J Sports Med. 2011 Jun;39(6):1226-32.
-
33Williams S, Trewartha G, Kemp S, Stokes K. A meta-analysis of injuries in senior men's professional Rugby Union. Sports Med. 2013 Oct;43(10):1043-55.
-
34Feddermann-Demont N, Junge A, Edouard P, Branco P, Alonso JM. Injuries in 13 international Athletics championships between 2007-2012. Br J Sports Med. 2014 Apr;48(7):513-22.
-
35Pollock N, James SL, Lee JC, Chakraverty R. British athletics muscle injury classification: a new grading system. Br J Sports Med. 2014 Sep;48(18):1347-51.
-
36Valle X, Alentorn-Geli E, Tol JL, et al. Muscle Injuries in Sports: A New Evidence-Informed and Expert Consensus-Based Classification with Clinical Application. Sports Med. 2017 Jul;47(7):1241-53.
-
37Armstrong RB. Initial events in exercise-induced muscular injury. Med Sci Sports Exerc. 1990 Aug;22(4):429-35.
-
38Petersen J, Thorborg K, Nielsen MB, Budtz-Jørgensen E, Hölmich P. Preventive effect of eccentric training on acute hamstring injuries in men's soccer: a cluster-randomized controlled trial. Am J Sports Med. 2011 Nov;39(11):2296-303.
-
39Silder A, Sherry MA, Sanfilippo J, Tuite MJ, Hetzel SJ, Heiderscheit BC. Clinical and morphological changes following 2 rehabilitation programs for acute hamstring strain injuries: a randomized clinical trial. J Orthop Sports Phys Ther. 2013 May;43(5):284-99.
-
40Cameron ML, Adams RD, Maher CG, Misson D. Effect of the HamSprint Drills training programme on lower limb neuromuscular control in Australian football players. J Sci Med Sport. 2009 Jan;12(1):24-30.
-
41Kraemer R, Knobloch K. A soccer-specific balance training program for hamstring muscle and patellar and achilles tendon injuries: an intervention study in premier league female soccer. Am J Sports Med. 2009 Jul;37(7):1384-93.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- La lesión de tendón, del eterno olvidado a una patología de moda
- Fisiología y mecanobiología del tejido tendinoso y muscular
- Tendinopatía rotuliana: diagnóstico ecográfico y por resonancia magnética. Alternativas de tratamiento conservador y quirúrgico
- Fisiopatología, diagnóstico y tratamiento de la tendinopatía aquílea
- Tendinopatía del supraespinoso: diagnóstico ecográfico y por resonancia magnética. Alternativas de tratamiento conservador y quirúrgico
- Resultados de reparación artroscópica de tendón glúteo medio en pacientes afectos de síndrome de dolor trocantérico. Serie de casos
- Actualización en el diagnóstico y el tratamiento de las lesiones musculares del cuádriceps
- Manejo de las lesiones musculares del tríceps sural en deportistas adultos jóvenes y de mediana edad: revisión narrativa de la literatura
- Tendinopatía insercional del tendón de Aquiles. Tratamiento de principio a fin
- Cíclope invertido
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.