Tendinopatía del supraespinoso: diagnóstico ecográfico y por resonancia magnética. Alternativas de tratamiento conservador y quirúrgico
Supraspinatus tendinopathy: diagnosis by ultrasound and magnetic resonance imaging. Conservative and surgical management alternatives
Resumen:
La tendinopatía del supraespinoso es una causa frecuente de dolor y disfunción de la articulación del hombro. En el término tendinopatía se engloban las entidades patológicas tendinitis, tendinosis y lesiones de espesor parcial. La presencia de un mecanismo lesional compatible junto a una meticulosa exploración y pruebas de imagen complementarias son indispensables para llegar a un diagnóstico correcto. Existe una amplia variedad de modalidades de tratamiento para la tendinopatía del supraespinoso. Las alternativas no quirúrgicas incluyen la modificación de la actividad, los antiinflamatorios no esteroideos, la fisioterapia y diversas terapias físicas, así como variedad de infiltraciones. La cirugía está reservada para pacientes concretos cuando las opciones más conservadoras se han agotado y/o fracasado. La acromioplastia no es una alternativa adecuada para el manejo de estos pacientes. El objetivo de esta revisión es presentar las diferentes alternativas diagnósticas y terapéuticas para la tendinopatía del supraespinoso, dada la elevada prevalencia de dicha entidad patológica.
Abstract:
Supraspinatus tendinopathy is a common cause of shoulder joint dysfunction and pain. The term tendinopathy encompasses tendinitis, tendinosis and partial thickness injuries. The existence of a compatible mechanism of injury, together with meticulous exploration and the use of complementary imaging techniques, are essential in order to establish a correct diagnosis. A broad range of treatment options are available for supraspinatus tendinopathy. The nonsurgical alternatives include the modification of patient activities, the prescription of nonsteroidal antiinflammatory drugs, physiotherapy and different physical therapies, and a range of infiltrations. Surgery is reserved for concrete patients when the more conservative options have been exhausted and/or have failed. Acromioplasty is not an adequate alternative for the management of these patients. The aim of this review is to describe the different diagnostic and therapeutic alternatives for supraspinatus tendinopathy, given the high prevalence of this disorder.
Introducción
El hombro doloroso es la tercera causa de consulta de dolor osteoarticular tras el de espalda y el de rodilla(1), y, en concreto, la patología del manguito rotador es una de las principales causas de dolor de hombro(2). La prevalencia de la patología del manguito aumenta a partir de los 40 años de edad(3), hasta el punto de que, con 60 años, el 50% de la población presenta alguna lesión que contribuye a la aparición de dolor y discapacidad, provocando gran impacto en la calidad de vida de quienes la sufren(4). Recientemente, se han identificado la edad superior a 50 años, la diabetes y las actividades que supongan elevar el brazo por encima del plano de la cabeza como factores de riesgo de tendinopatía del manguito rotador(5). El objetivo principal de esta revisión es presentar las diferentes alternativas diagnósticas y terapéuticas para la tendinopatía del supraespinoso que creemos de gran relevancia, dada la elevada prevalencia de dicha entidad patológica.
Fisiopatología
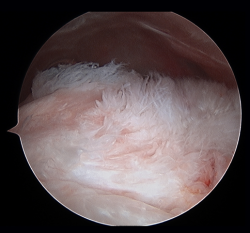
Tradicionalmente, la aparición de la patología del manguito se ha descrito como una alteración progresiva, que comienza en una tendinitis aguda, continúa como una tendinosis con degeneración tisular y roturas parciales, que finaliza con roturas de espesor completo(6). Los términos tendinitis y tendinosis representan diferentes estadios de la tendinopatía. Tendinitis se emplea para definir dolor agudo o crónico acompañado, por definición, de inflamación, a pesar de que los estudios histológicos demuestran ausencia o una mínima presencia de células inflamatorias(7). Tendinosis se emplea para describir patología degenerativa con o sin inflamación (Figura 1). Tendinopatía es el término que describe un cuadro clínico consistente en dolor y función alterada de los tendones del manguito rotador sin conocer el mecanismo subyacente específico(8).
La etiología de la tendinopatía del manguito es multifactorial y comprende mecanismos tanto extrínsecos como intrínsecos(9).
Los mecanismos extrínsecos resultan en una compresión del lado bursal del tendón del supraespinoso (pinzamiento o impingement externo) o del lado articular (pinzamiento o impingement interno), e incluyen factores anatómicos, biomecánicos y la combinación de ambos. La presencia de variantes anatómicas tales como osteofitos acromiales, osificación de la inserción del ligamento coracoacromial o diferentes morfologías del acromion puede contribuir como mecanismo de aparición de una tendinopatía(10), pero el papel real que tiene en el desarrollo de la tendinopatía es limitado: las distintas morfologías acromiales tal como fueron descritas por Neer et al.(11) y Bigliani et al.(12) aparecen con incidencia similar en sujetos sin trastornos del tendón y no cambian con la edad; además, los osteofitos acromiales y la calcificación del ligamento coracoacromial que aparecen asociados a la tendinopatía, pero no son causa de esta, parecen más bien consecuencias de la compresión extrínseca. El papel que tiene la lateralización del acromion, medida con el índice acromial(13), o la relación entre esta lateralización y la inclinación craneocaudal de la superficie de la glena, medida con el ángulo crítico del hombro(14), están en plena discusión, pero parece claro que aquellos sujetos con índices acromiales elevados y/o ángulos críticos de hombro mayores presentan más tendinopatías del supraespinoso y más roturas de este tendón(15). Sí son claves en el desarrollo del trastorno la presencia de alteraciones biomecánicas como la discinesia escapulotorácica(16,17), la disfunción muscular, la disminución de la elasticidad del pectoral menor o alteraciones posturales que producen alteraciones más o menos dinámicas de la posición de la escápula y del acromion, que causan compresión sobre el tendón y desembocan en una tendinopatía.
Los mecanismos intrínsecos están relacionados directamente con la estructura histológica del tendón, su vascularización y la distribución de fuerzas dentro de sus fibras, así como los cambios que en estas circunstancias se producen durante el envejecimiento. Existen zonas en las que una sobrecarga mecánica, asociada a una pobre vascularización con capacidad regenerativa limitada, condicionan una degradación de colágeno de tipo I, aumento de la proporción de colágeno de tipo III y alteración de la organización del colágeno de tipo VI(18,19), lo cual conlleva un empeoramiento de las propiedades mecánicas del tendón ante fuerzas de tensión y de roce y, en consecuencia, la aparición de zonas de rotura que pueden progresar al sobrecargar las zonas adyacentes.
Así pues, las entidades patológicas englobadas en el término tendinopatía son las tendinitis, tendinosis y lesiones de espesor parcial. Las lesiones de espesor completo quedan fuera del foco de este artículo. En cuanto a la tendinopatía calcificante del supraespinoso, la trataremos como entidad propia dado que, siendo una tendinopatía como tal, su mecanismo de aparición no ha sido consensuado todavía, existiendo varias hipótesis para el mismo(20), y que su diagnóstico por imagen difiere del resto de las entidades.
Diagnóstico
Una meticulosa exploración, la presencia de mecanismos lesionales claros y pruebas de imagen compatibles son indispensables para llegar a un diagnóstico correcto. No es objeto de este texto la revisión de la exploración de la cintura escapular. La ecografía, la resonancia magnética nuclear (RMN) y la artrorresonancia (artro-RMN) aportan información útil en cuanto a las alteraciones morfológicas que aparecen en el proceso de desarrollo de la tendinopatía y, por tanto, pueden ayudar a la hora de elegir el tratamiento más adecuado(21).
Diagnóstico por ecografía
Uno de los aspectos que más ha cambiado últimamente en relación con las pruebas de imagen es el aumento del uso de los ecógrafos fuera de los servicios de radiología como prueba complementaria a la exploración física, por ejemplo, en el ámbito de la patología deportiva o traumatológica(22). El hecho de que el resultado de la ecografía dependa de quién la realiza obliga a estar entrenado para obtener resultados fiables y útiles. Entre las ventajas de la ecografía se encuentran el precio, la seguridad del procedimiento, que está disponible en prácticamente cualquier centro sanitario, que podemos realizar de forma rápida y sencilla una comparación frente al miembro sano, que la exploración se puede realizar de forma dinámica y la excelente correlación interobservador para muchas patologías del hombro. Además, se pueden realizar infiltraciones más precisas que guiadas por referencias anatómicas(23) o terapias ecoguiadas como el “barbotaje” para las tendinitis cálcicas(24).
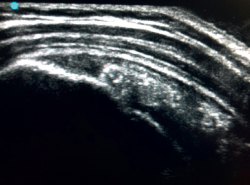
Para una buena valoración ecográfica del manguito posterosuperior (Figura 2), se solicita al paciente que coloque su brazo detrás de su espalda, con la mano intentando tocar el vértice inferior de la escápula (posición de Crass). En el supuesto de que el paciente no sea capaz de alcanzar o mantener esta posición durante la exploración, se le solicitará que coloque la palma de la mano en la cresta ilíaca anterosuperior ipsilateral y el codo en flexión (modificación de la posición de Crass o posición de Middleton)(25). Es importante explorar el tendón hasta su borde más anterior, dado que es lugar de frecuente asiento de lesiones sintomáticas, y, para ello, en ocasiones es preciso llevar el codo hacia atrás eliminando los últimos grados de rotación interna.
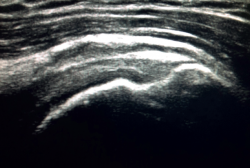
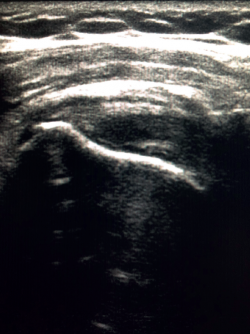
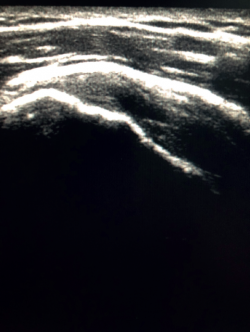
La imagen ecográfica propia de una tendinosis corresponde con un engrosamiento local o difuso acompañado de un aspecto hipoecogénico y heterogéneo del tendón (Figura 3). Una línea fina e hipoecoica mayor de 2 mm de grosor entre el tendón del supraespinoso y la grasa subdeltoidea corresponde con una bursitis subacromiosubdeltoidea y la presencia de líquido en la bursa se relaciona con elevada probabilidad con una lesión parcial o completa del tendón del supraespinoso(26). Para mayor exactitud diagnóstica y diferenciar un proceso inflamatorio de una pequeña cantidad normal de fluido en la bursa, en las bursitis, tenosinovitis y tendinitis hay presencia de zonas hiperecoicas con áreas de aumento de flujo en el Doppler. Las roturas parciales, tanto bursales como articulares, se ven como una discontinuidad hipoecoica en el tendón que no cambia al modificar la inclinación de la sonda ni en el eje largo del tendón ni en el corto(19). Este último aspecto es importante para no confundir lesiones parciales con el fenómeno de anisotropía, que es un cambio en el comportamiento del tejido en función del ángulo de incidencia del ultrasonido(27) (Figura 4).
Las tendinitis cálcicas ofrecen diferentes imágenes dependiendo del estadio en el que se encuentran. Así, los depósitos hiperecoicos, bien definidos y con sombra acústica bien definida representan a una tendinitis cálcica en fase formativa. En la fase de reposo, los depósitos son hiperecoicos, con forma de arco y sombra acústica débil, y en la fase resortiva los depósitos son fragmentados o nodulares con escasa sombra acústica (Figura 5). Además, en la fase resortiva, el Doppler refleja un aumento de la vascularización alrededor de las calcificaciones(28).
La sonoelastografía es una variante de la ecografía que mide la elasticidad del tejido explorado a tiempo real. Se basa en que la compresión de los tejidos blandos provoca un desplazamiento de los mismos, de tal manera que aquellos tejidos más rígidos se desplazan menos(29). Este desplazamiento se calcula en tiempo real y se muestra en el monitor del ecógrafo en una escala de colores. Por tanto, con la sonoelastografía se pueden diagnosticar cambios en la ecoestructura tendinosa tales como edema, degeneración tisular o lesiones parciales de muy pequeño tamaño que por ecografía convencional podrían pasar desapercibidas(30,31).
Diagnóstico por resonancia magnética nuclear
La RMN es un método diagnóstico no invasivo, ampliamente usado en la práctica clínica para el estudio de la patología musculoesquelética y concretamente en el estudio del manguito rotador del hombro. Tiene una alta sensibilidad y especificidad en las lesiones del manguito y tiene niveles elevados de reproducibilidad interobservador, siempre que estos sean expertos en hombro o radiólogos experimentados(32).
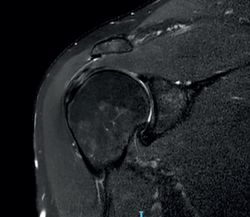
La imagen propia de una tendinosis en RMN es una zona focal o intrasustancia de señal intermedia en T1 que no desaparece en T2 y sin alcanzar la intensidad del fluido en T2 (Figura 6). En ocasiones, se puede observar un engrosamiento difuso o focal del tendón sin evidencia de rotura(33). Una tendinosis puede ser difícil de diferenciar de una rotura parcial en estadio temprano de esta última.
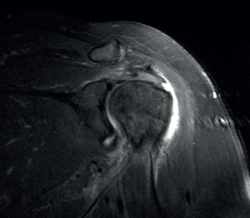
Una lesión es clasificada como de espesor parcial si, en una secuencia T2, una señal anormal de intensidad de fluido se extiende a través de una porción del tendón sin violar su espesor completo (Figura 7). Estas lesiones pueden ser bursales o articulares, siendo las articulares las más frecuentes. Existe la posibilidad de que el espesor de la lesión parcial esté ocupado por tejido cicatricial o de granulación, dificultando el diagnóstico. Se ha sugerido que el uso de la artro-RMN en posición de ABER (abducción + rotación externa) puede mejorar el diagnóstico y la tipificación de estas lesiones(34). Según Ellman(35), las lesiones de espesor parcial de pueden clasificar en 3 grados: grado I si la profundidad de la misma es < 3 mm; grado II si la profundidad es de 3 a 6 mm; y grado III si es > 6 mm. Teniendo en cuenta que un supraespinoso sano tiene un grosor de entre 10 y 12 mm, las de grado III afectan a más del 50% del espesor. Las lesiones intrasustancia se presentan con una señal de tipo fluido en el espesor del tendón sin extensión a la bursa o al espacio articular.
Los llamados quistes centinela(36) son quistes intramusculares formados por una colección de líquido que fuga desde el espacio articular a través de un defecto en el manguito rotador y que sugieren una lesión del mismo por delaminación.
Tratamiento
La base del tratamiento de los pacientes con tendinopatía del supraespinoso debe ser la educación del paciente, la reducción del dolor, el control de las cargas mecánicas sobre el tendón (infra- o sobrecargado) y la prevención de las recaídas(37).
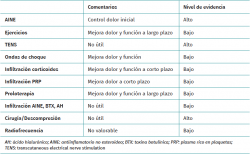
Dependiendo de la patología concreta de los pacientes, así como de la edad, el nivel de actividad, los síntomas, el nivel de la disfunción y los hallazgos en el examen físico y la toma de imágenes, se ha descrito una amplia variedad de modalidades de tratamiento para la tendinopatía del supraespinoso. Las no quirúrgicas incluyen la modificación de la actividad, antiinflamatorios no esteroideos (AINE), fisioterapia y diversas terapias físicas, así como variedad de infiltraciones. La opción quirúrgica está generalmente reservada para determinados pacientes concretos o cuando las opciones más conservadoras se han agotado y/o fracasado. Un resumen de todas ellas queda reflejado en la Tabla 1.
Alternativas no quirúrgicas
El uso de AINE por vía oral tanto en la fase inicial como en la crónica de cualquier proceso doloroso es de amplia difusión en nuestra sociedad. No está claramente demostrada su utilidad en la modificación de la enfermedad de las tendinopatías. En el caso concreto de la tendinopatía del supraespinoso, la presencia de inflamación tanto en el tendón como en la bursa parece ser una característica en las fases iniciales de un tendón patológico. Los AINE selectivos pueden producir una inhibición de la proliferación celular y de la síntesis de factores proinflamatorios(38,39). Por otro lado, los AINE no producen esta misma respuesta a nivel celular cuando se trata de tenocitos obtenidos por biopsia en sujetos con tendinopatía(40). En resumen, los AINE pueden ser útiles en las fases iniciales para el manejo del dolor y la inflamación. Sin embargo, su uso no modifica la evolución ni trata la tendinopatía.
La terapia manual comprende el movimiento de las articulaciones y otras estructuras por parte de un profesional sanitario (por ejemplo, fisioterapeuta). El ejercicio incluye cualquier movimiento intencional de una articulación, contracción muscular o actividad prescrita. Los objetivos de ambos tratamientos son aliviar el dolor, aumentar el rango de movilidad de las articulaciones y mejorar la fuerza y la función. Una revisión de la Cochrane de 2016(41) solo encontró un artículo con la calidad suficiente que comparara estos tratamientos con el placebo. El resto de las referencias bibliográficas eran de bajo nivel como para sacar conclusiones con certeza. Bennell(42), en su estudio que evalúa la terapia manual asociada a un protocolo de ejercicios domiciliarios, no encontró diferencias ni en mejora del dolor ni en mejora de la función a las 10 semanas de tratamiento en comparación con el placebo. Otras revisiones(43) han incidido en la baja evidencia existente sobre el efecto de estos tratamientos; sin embargo, parece que puedan mejorar el dolor sin tener una clara influencia sobre la función de la articulación.
Los protocolos de ejercicios domiciliarios se han considerado de forma general como el tratamiento de base de la tendinopatía del supraespinoso(44,45), asociando su mejoría a su capacidad de generar cambios estructurales en el tendón(46). Esto parece estar más relacionado con el uso de ejercicios de entrenamiento de resistencia pesado-lento(47) (heavy-slow resistance training). También se ha asociado esta mejoría a cambios en la sensibilidad tanto central como periférica del sistema nervioso, producidos por la actividad física(47). Heron(48), en un estudio clínico que evaluaba diferentes modelos de ejercicios de cadena abierta, cadera cerrada o rango de movilidad, describe una influencia favorable de todos respecto del dolor y la función, sin diferencias entre los distintos protocolos de ejercicios, aconsejando la asociación de los mismos.
Parece evidente que, aparte de los factores intrínsecos que puedan generar una tendinopatía en el supraespinoso, se deben vigilar y observar los factores extrínsecos que generan un pinzamiento. Dentro de este grupo, una de las principales causas es la discinesia escapulotorácica, alteración que puede manejarse específicamente con un protocolo de ejercicios específico y adecuado(49).
La estimulación eléctrica transcutánea (transcutaneous electrical nerve stimulation –TENS–) es un tratamiento habitual en fisioterapia para tratar dolor musculoesquelético. Se hipotetiza que su efecto analgésico se produce por la activación periférica de las fibras aferentes A-beta, responsables del bloqueo de la transmisión del dolor (teoría de la puerta de entrada). Sin embargo, su utilidad en el manejo de la tendinopatía del supraespinoso no se ha podido demostrar. En 2 revisiones disponibles, una de la Cochrane de 2016(50) y otra de Desmeules et al.(51), no han encontrado estudios de la calidad suficiente que permita recomendar el uso de la TENS y aconsejan el uso de otros tipos de tratamiento que hayan podido demostrar más eficacia.
El uso de LASER (light amplification by stimulated emission of radiation), terapia con luz infrarroja, podría tener cierto efecto beneficioso para el control del dolor a corto plazo según una revisión de la Cochrane(50).
El tratamiento con ondas de choque puede ser efectivo en el tratamiento de la tendinopatía calcificante del supraespinoso, así como tendinopatías en otras localizaciones anatómicas, asociado a la estimulación de formación de neovascularización y liberación temprana de factores de crecimiento en la unión tendón-hueso(52). Su uso en la tendinopatía del supraespinoso no calcificante se ha estudiado poco. Galasso et al.(53) lo probaron en 20 pacientes en un estudio aleatorizado comparado con placebo y usaron un protocolo de 2 sesiones con ondas de choque de bajo grado. A los 3 meses describieron una mejoría significativa de la escala de Constant del grupo tratado respecto al grupo control/placebo. Chou et al.(54) evaluaron un grupo de pacientes, en el que incluían atletas con “lanzamiento por encima de la cabeza”, a los que sometían a 1 o 2 sesiones de ondas de choque. En ambos grupos, atletas y no atletas, se objetivó una curación en torno al 50% de los pacientes al año de seguimiento. Considerando que las ondas de choque son un tratamiento con escasas complicaciones (el dolor durante las sesiones es la principal queja), su uso es adecuado como una opción previa a otros tratamientos más agresivos.
Existen diversas opciones de infiltraciones como tratamiento o complemento a otros tratamientos de la tendinopatía del supraespinoso. Se ha descrito el uso de infiltraciones de corticosteroides, AINE, ácido hialurónico (AH), toxina botulínica (BTX), plasma rico en plaquetas (PRP) y proloterapia (infiltración de dextrosa hipertónica)(55).
De todos ellos, los corticosteroides (metilprednisolona, triamcinolona, betametasona, dexametasona) son los más ampliamente extendidos, lo cual es un poco debatible, ya que la tendinopatía no es un proceso inflamatorio sino degenerativo. Sin embargo, los estudios in vitro evidencian que los corticosteroides tienen un efecto sobre el tendón y el tejido conectivo circundante inhibiendo la producción de tejido de granulación, matriz extracelular y colágeno, asociado al efecto antiinflamatorio(56). Parece ser que este efecto positivo solo estaría presente en el corto plazo(57) y en estudios con células in vitro se ha evidenciado que los corticosteroides tienen un efecto deletéreo sobre la viabilidad celular, su proliferación y las características mecánicas del tendón(58). Este efecto demostrado in vitro no se ha correlacionado con los resultados clínicos, ya que no se describen eventos de rotura del tendón en ninguna de las revisiones, describiéndose solo las complicaciones habituales del rubor facial, dolor y cambios en la pigmentación cutánea(56).
Respecto del uso del PRP, lo primero que hay que destacar es la gran variabilidad existente en los métodos de producción del mismo, con obtención de productos similares, que no iguales, así como diversidad de protocolos de tratamiento y aplicación, lo que da gran heterogeneidad entre los estudios clínicos, con lo que es difícil obtener resultados valorables en los artículos de revisión. Lin et al.(55), en su revisión sistemática, concluyen que observan un efecto positivo del uso de PRP subacromial a largo plazo (por encima de 24 semanas), efecto que no se ha objetivado ni a corto ni a largo plazo en otras revisiones también recientes(59,60). Sí que es verdad que el PRP se ha planteado por algunos autores como sustituto de los corticosteroides por su efecto analgésico inicial, sin que se establezcan diferencias de efectividad entre ambos tratamientos, y así poder obviar las posibles complicaciones de los corticosteroides(61).
Se ha estudiado in vitro con tenocitos el uso concomitante de PRP y corticosteroides(62), y se evidenció que el efecto antiinflamatorio de los corticosteroides no se alteraba y, por el contrario, se contrarrestaba el efecto deletéreo sobre los tenocitos de los mismos, induciendo el PRP la síntesis de colágeno de tipo I y disminuyendo la apoptosis celular. Por tanto, continúa la duda sobre la verdadera utilidad de este tratamiento.
La proloterapia o inyección de dextrosa hipertónica se basa en la teoría de que un agente irritante va a provocar un proceso inflamatorio local en el tendón que permita la reparación o formación de cicatriz(63). Respecto de este tratamiento en la tendinopatía del supraespinoso, la mayor parte de la evidencia disponible está basada en pequeñas series retrospectivas. Catapano et al.(64), en una revisión sistemática reciente, hace referencia a la variabilidad de modelos de tratamiento, infiltración intratendón o en entesis, así como de grupos control, corticoides, fisioterapia o placebo. En todo caso, concluye que parece que existe una influencia positiva con el tratamiento con dextrosa hipertónica, aparentemente más evidente con infiltraciones repetidas en la entesis. Bertrand et al.(65) realizaron un estudio clínico aleatorizado comparando en 73 pacientes la infiltración de dextrosa hipertónica con la infiltración de suero salino en la entesis y la infiltración de suero salino en la bursa. Con la dextrosa hipertónica se obtuvo una mejoría del dolor y de la satisfacción de los pacientes significativamente superior a los otros 2 tratamientos y más duradera en el tiempo (hasta 9 meses). Este resultado, asociado a los beneficios descritos en otras tendinopatías(63), hace que la proloterapia pueda tener una efectividad a largo plazo en el manejo de la tendinopatía del supraespinoso(55), aunque queda pendiente por definir el modelo y el modo más adecuado para su utilización.
Respecto del uso de infiltraciones con AINE, no han demostrado ser superiores al uso de corticosteroides(66,67). En relación con la BTX, se ha preconizado su uso en el dolor de hombro en pacientes con hemiplejia(68). El AH no ha demostrado utilidad en pacientes sin osteoartritis(55).
En resumen, se puede concluir que hay moderada evidencia de que las infiltraciones con corticosteroides tienen un beneficio de control del dolor a corto plazo y que la proloterapia puede ser un tratamiento esperanzador para la mejoría a largo plazo. En cualquier caso, para una adecuada utilización de estos tratamientos, el uso de la infiltración ecoguiada permite una localización más acertada de su implantación, al evidenciarse el alto porcentaje de infiltraciones en localización no deseada cuando se realizan con un método “ciego”. Se describe un acierto en el espacio subacromial del 70%, localizándose en el deltoides en el 21%, en la articulación glenohumeral en el 4% y subcutáneo en el 5%(63).
Alternativas quirúrgicas
La descompresión subacromial como tratamiento de las tendinopatías crónicas del supraespinoso ha sido un tratamiento ampliamente recomendado y utilizado. La acromioplastia ha sido comparada con diversos tratamientos como placebo, terapia física, infiltraciones con corticoides, bursectomía aislada, sin encontrar diferencias respecto de ninguna de ellas(69). Ketola et al. no encontraron diferencias entre el tratamiento quirúrgico mediante descompresión subacromial artroscópica y el conservador tras 12 años de seguimiento en pacientes con síndrome subacromial. Por tanto, no se puede recomendar la acromioplastia como tratamiento de la tendinopatía del supraespinoso(70). Adicionalmente, el papel de una acromioplastia “lateral” para modificar la cobertura lateral del acromion está muy discutido(71).
Otra alternativa quirúrgica es la microtenotomía por radiofrecuencia(72). Los estudios disponibles(72,73) comparan la radiofrecuencia con la descompresión subacromial, obteniendo similares resultados a 2 años de seguimiento. Se describe a la radiofrecuencia como ventajosa respecto a la acromioplastia en que evita la resección ósea y del ligamento coracoacromial, que podrían ser parte de los efectos deletéreos de la descompresión subacromial.
En relación con las lesiones parciales del manguito, no existe evidencia científica actual que determine cuál es el mejor tratamiento para dichas lesiones sintomáticas. Esto es debido a que es complejo comparar los resultados de las distintas alternativas terapéuticas dada la heterogeneidad de la lesión en estudio y de las herramientas empleadas para evaluar los resultados de los diferentes tratamientos(74). El desbridamiento artroscópico con o sin acromioplastia para las lesiones de grado I/II de Ellman(35) y las diferentes técnicas de reparación (transtendínea o completando la rotura) para las lesiones de grado III de Ellman son las alternativas quirúrgicas más difundidas.
En cuanto al tratamiento de la tendinitis calcificante del supraespinoso(28), la primera línea terapéutica la constituyen la rehabilitación, los AINE y las infiltraciones con corticoides, pero el porcentaje de fracasos es próximo al 30%, dado que ninguna de estas alternativas elimina el depósito de calcio. La probabilidad de fracaso es mayor en aquellas calcificaciones grandes, bilaterales, que se extienden más allá del borde medial del acromion o que están bajo el tercio anterior del mismo. Las calcificaciones en fase formativa, densas y homogéneas (tipo I de Gärtner y Heyer) parecen beneficiarse del tratamiento con ondas de choque y aquellas en fase de reposo o resortiva (tipos II y III de Gärtner y Heyer), heterogéneas, segmentadas y mal delimitadas cuyo contenido es fluido se benefician de tratamiento mediante lavado percutáneo con control ecográfico, también conocido como “barbotaje”(75).
Conclusiones
La tendinopatía del supraespinoso es causa frecuente de dolor y disfunción del hombro y comprende entidades patológicas que van desde la tendinitis hasta las roturas parciales. La ecografía en manos expertas o entrenadas es un método excelente para su diagnóstico con las principales ventajas de su gran accesibilidad, la posibilidad de realizar exploración comparativa con el miembro sano y exploración dinámica, además de poder realizar terapias ecoguiadas. La RMN es otro método no invasivo de diagnóstico por imagen, altamente extendido, con una elevada sensibilidad y especificidad, que ofrece una gran calidad de imagen e información acerca de lesiones concomitantes. Los tratamientos descritos para la tendinopatía del supraespinoso son muy variados y la decisión terapéutica dependerá del tipo de paciente a tratar y el momento o el tipo de lesión.
Figuras
Figura 1. Visión artroscópica desde portal posterior de una tendinosis grave del supraespinoso de un hombro izquierdo.
Figura 4. Fenómeno de anisotropía en la inserción del tendón del supraespinoso. No confundir con lesión de espesor parcial.
Figura 5. Visión ecográfica de una tendinopatía calcificante del supraespinoso de tipo III de Gärtner y Heyer.
Figura 7. Rotura de espesor parcial bursal del supraespinoso en visión por resonancia magnética nuclear.
Tablas
Información del artículo
Cita bibliográfica
Autores
Santos Moros Marco
Servicio de Traumatología. Hospital MAZ. Zaragoza
Cirugía Ortopédica y Traumatología. Unidad de Miembro Superior. Hospital MAZ Zaragoza. Arthrosport Zaragoza
Editor asociado de REACA
Servicio de Traumatología y Cirugía Ortopédica. Hospital de la Mutua MAZ. Zaragoza
Jorge Díaz Heredia
Cirugía Ortopédica y Traumatología. Unidad de Hombro y Codo. Hospital Universitario Ramón y Cajal. Madrid
Clínica La Antigua. Guadalajara
Editor asociado de REACA
Miguel Ángel Ruiz Ibán
Director de REACA
Cirugía Ortopédica y Traumatología. Unidad de Hombro y Codo. Hospital Universitario Ramón y Cajal. Madrid
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de interés.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Brox JI. Regional musculoskeletal conditions: shoulder pain. Best Pract Res Clin Rheumatol. 2003;17(1):33-56.
-
2Van der Windt DA, Koes BW, Boeke AJ, Deville W, De Jong BA, Bouter LM. Shoulder disorders in general practice: prognostic indicators of outcome. Br J Gen Pract. 1996;46(410):519-23.
-
3Tempelhof S, Rupp S, Seil R. Age-related prevalence of rotator cuff tears in asymptomatic shoulders. J Shoulder Elbow Surg. 1999;8(4):296-9.
-
4MacDermid JC, Ramos J, Drosdowech D, Faber K, Patterson S. The impact of rotator cuff pathology on isometric and isokinetic strength, function, and quality of life. J Shoulder Elbow Surg. 2004;13(6):593-8.
-
5Leong HT, Fu SC, He X, Oh JH, Yamamoto N, Hang S. Risk factors for rotator cuff tendinopathy: a systematic review and meta-analysis. J Rehabil Med. 2019;51(9):627-37.
-
6Neer CS 2nd. Impingement lesions. Clin Orthop Relat Res. 1983(173):70-7.
-
7Fukuda H, Hamada K, Yamanaka K. Pathology and pathogenesis of bursal-side rotator cuff tears viewed from en bloc histologic sections. Clin Orthop Relat Res. 1990(254):75-80.
-
8Fredberg U, Stengaard-Pedersen K. Chronic tendinopathy tissue pathology, pain mechanisms, and etiology with a special focus on inflammation. Scand J Med Sci Sports. 2008;18(1):3-15.
-
9Seitz AL, McClure PW, Finucane S, Boardman ND 3rd, Michener LA. Mechanisms of rotator cuff tendinopathy: intrinsic, extrinsic, or both? Clin Biomech (Bristol, Avon). 2011;26(1):1-12.
-
10Soslowsky LJ, Thomopoulos S, Esmail A, et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 2002;30(8):1057-63.
-
11Neer CS 2nd. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 1972;54(1):41-50.
-
12Bigliani LU, Morrison DS, April EW. The morphology of the acromion and its relationship to rotator cuff tears. Ortho Trans. 1986;10
-
13Nyffeler RW, Werner CM, Sukthankar A, Schmid MR, Gerber C. Association of a large lateral extension of the acromion with rotator cuff tears. J Bone Joint Surg Am. 2006;88(4):800-5.
-
14Moor BK, Bouaicha S, Rothenfluh DA, Sukthankar A, Gerber C. Is there an association between the individual anatomy of the scapula and the development of rotator cuff tears or osteoarthritis of the glenohumeral joint?: a radiological study of the critical shoulder angle. Bone Joint J. 2013;95-B(7):935-41.
-
15Smith GCS, Liu V, Lam PH. The Critical Shoulder Angle Shows a Reciprocal Change in Magnitude When Evaluating Symptomatic Full-Thickness Rotator Cuff Tears Versus Primary Glenohumeral Osteoarthritis as Compared With Control Subjects: A Systematic Review and Meta-analysis. Arthroscopy. 2020;36(2):566-75.
-
16Roche SJ, Funk L, Sciascia A, Kibler WB. Scapular dyskinesis: the surgeon's perspective. Shoulder Elbow. 2015;7(4):289-97.
-
17McClure PW, Michener LA, Karduna AR. Shoulder function and 3-dimensional scapular kinematics in people with and without shoulder impingement syndrome. Phys Ther. 2006;86(8):1075-90.
-
18Riley GP, Harrall RL, Constant CR, Chard MD, Cawston TE, Hazleman BL. Tendon degeneration and chronic shoulder pain: changes in the collagen composition of the human rotator cuff tendons in rotator cuff tendinitis. Ann Rheum Dis. 1994;53(6):359-66.
-
19Thakkar D, Grant TM, Hakimi O, Carr AJ. Distribution and expression of type VI collagen and elastic fibers in human rotator cuff tendon tears. Connect Tissue Res. 2014;55(5-6):397-402.
-
20Suzuki K, Potts A, Anakwenze O, Singh A. Calcific tendinitis of the rotator cuff: management options. J Am Acad Orthop Surg. 2014;22(11):707-17.
-
21Roy JS, Braen C, Leblond J, et al. Diagnostic accuracy of ultrasonography, MRI and MR arthrography in the characterisation of rotator cuff disorders: a systematic review and meta-analysis. Br J Sports Med. 2015;49(20):1316-28.
-
22Harmon KG, O'Connor FG. Musculoskeletal ultrasound: taking sports medicine to the next level. Br J Sports Med. 2010;44(16):1135-6.
-
23Aly AR, Rajasekaran S, Ashworth N. Ultrasound-guided shoulder girdle injections are more accurate and more effective than landmark-guided injections: a systematic review and meta-analysis. Br J Sports Med. 2015;49(16):1042-9.
-
24Yoo JC, Koh KH, Park WH, Park JC, Kim SM, Yoon YC. The outcome of ultrasound-guided needle decompression and steroid injection in calcific tendinitis. J Shoulder Elbow Surg. 2010;19(4):596-600.
-
25Zheng F, Wang H, Gong H, Fan H, Zhang K, Du L. Role of Ultrasound in the Detection of Rotator-Cuff Syndrome: An Observational Study. Med Sci Monit. 2019;25:5856-63.
-
26Jacobson JA, Lancaster S, Prasad A, van Holsbeeck MT, Craig JG, Kolowich P. Full-thickness and partial-thickness supraspinatus tendon tears: value of US signs in diagnosis. Radiology. 2004;230(1):234-42.
-
27Singh JP. Shoulder ultrasound: What you need to know. Indian J Radiol Imaging. 2012;22(4):284-92.
-
28Merolla G, Singh S, Paladini P, Porcellini G. Calcific tendinitis of the rotator cuff: state of the art in diagnosis and treatment. J Orthop Traumatol. 2016;17(1):7-14.
-
29Yanagisawa O, Niitsu M, Kurihara T, Fukubayashi T. Evaluation of human muscle hardness after dynamic exercise with ultrasound real-time tissue elastography: a feasibility study. Clin Radiol. 2011;66(9):815-9.
-
30Vasishta A, Kelkar A, Joshi P, Hapse R. The value of sonoelastography in the diagnosis of supraspinatus tendinopathy-a comparison study. Br J Radiol. 2019;92(1095):20180951.
-
31Seo JB, Yoo JS, Ryu JW. Sonoelastography findings of supraspinatus tendon in rotator cuff tendinopathy without tear: comparison with magnetic resonance images and conventional ultrasonography. J Ultrasound. 2015;18(2):143-9.
-
32Jain NB, Collins J, Newman JS, Katz JN, Losina E, Higgins LD. Reliability of magnetic resonance imaging assessment of rotator cuff: the ROW study. PM R. 2015;7(3):245-54 e243; quiz 254.
-
33Opsha O, Malik A, Baltazar R, et al. MRI of the rotator cuff and internal derangement. Eur J Radiol. 2008;68(1):36-56.
-
34Herold T, Bachthaler M, Hamer OW, et al. Indirect MR arthrography of the shoulder: use of abduction and external rotation to detect full- and partial-thickness tears of the supraspinatus tendon. Radiology. 2006;240(1):152-60.
-
35Ellman H. Diagnosis and treatment of incomplete rotator cuff tears. Clin Orthop Relat Res. 1990(254):64-74.
-
36Sanders TG, Tirman PF, Feller JF, Genant HK. Association of intramuscular cysts of the rotator cuff with tears of the rotator cuff: magnetic resonance imaging findings and clinical significance. Arthroscopy. 2000;16(3):230-5.
-
37Lewis JS. Rotator cuff tendinopathy: a model for the continuum of pathology and related management. Br J Sports Med. 2010;44(13):918-23.
-
38Riley GP, Cox M, Harrall RL, Clements S, Hazleman BL. Inhibition of tendon cell proliferation and matrix glycosaminoglycan synthesis by non-steroidal anti-inflammatory drugs in vitro. J Hand Surg Br. 2001;26(3):224-8.
-
39Tsai WC, Tang FT, Hsu CC, Hsu YH, Pang JH, Shiue CC. Ibuprofen inhibition of tendon cell proliferation and upregulation of the cyclin kinase inhibitor p21CIP1. J Orthop Res. 2004;22(3):586-91.
-
40Heinemeier KM, Ohlenschlaeger TF, Mikkelsen UR, et al. Effects of anti-inflammatory (NSAID) treatment on human tendinopathic tissue. J Appl Physiol (1985). 2017;123(5):1397-405.
-
41Page MJ, Green S, McBain B, et al. Manual therapy and exercise for rotator cuff disease. Cochrane Database Syst Rev. 2016(6):CD012224.
-
42Bennell K, Coburn S, Wee E, et al. Efficacy and cost-effectiveness of a physiotherapy program for chronic rotator cuff pathology: a protocol for a randomised, double-blind, placebo-controlled trial. BMC Musculoskelet Disord. 2007;8:86.
-
43Desjardins-Charbonneau A, Roy JS, Dionne CE, Fremont P, MacDermid JC, Desmeules F. The efficacy of manual therapy for rotator cuff tendinopathy: a systematic review and meta-analysis. J Orthop Sports Phys Ther. 2015;45(5):330-50.
-
44Steuri R, Sattelmayer M, Elsig S, et al. Effectiveness of conservative interventions including exercise, manual therapy and medical management in adults with shoulder impingement: a systematic review and meta-analysis of RCTs. Br J Sports Med. 2017 Sep;51(18):1340-7.
-
45Littlewood C, Ashton J, Chance-Larsen K, May S, Sturrock B. Exercise for rotator cuff tendinopathy: a systematic review. Physiotherapy. 2012;98(2):101-9.
-
46Cook JL, Purdam CR. Is tendon pathology a continuum? A pathology model to explain the clinical presentation of load-induced tendinopathy. Br J Sports Med. 2009;43(6):409-16.
-
47Drew BT, Smith TO, Littlewood C, Sturrock B. Do structural changes (eg, collagen/matrix) explain the response to therapeutic exercises in tendinopathy: a systematic review. Br J Sports Med. 2014;48(12):966-72.
-
48Heron SR, Woby SR, Thompson DP. Comparison of three types of exercise in the treatment of rotator cuff tendinopathy/shoulder impingement syndrome: a randomized controlled trial. Physiotherapy. 2017;103(2):167-73.
-
49Panagiotopoulos AC, Crowther IM. Scapular dyskinesia, the forgotten culprit of shoulder pain and how to rehabilitate. SICOT J. 2019;5:29.
-
50Page MJ, Green S, Mrocki MA, et al. Electrotherapy modalities for rotator cuff disease. Cochrane Database Syst Rev. 2016(6):CD012225.
-
51Desmeules F, Boudreault J, Roy JS, Dionne CE, Fremont P, MacDermid JC. Efficacy of transcutaneous electrical nerve stimulation for rotator cuff tendinopathy: a systematic review. Physiotherapy. 2016;102(1):41-9.
-
52Wang CJ, Wang FS, Yang KD, et al. Shock wave therapy induces neovascularization at the tendon-bone junction. A study in rabbits. J Orthop Res. 2003;21(6):984-9.
-
53Galasso O, Amelio E, Riccelli DA, Gasparini G. Short-term outcomes of extracorporeal shock wave therapy for the treatment of chronic non-calcific tendinopathy of the supraspinatus: a double-blind, randomized, placebo-controlled trial. BMC Musculoskelet Disord. 2012;13:86.
-
54Chou WY, Wang CJ, Wu KT, Yang YJ, Cheng JH, Wang SW. Comparative outcomes of extracorporeal shockwave therapy for shoulder tendinitis or partial tears of the rotator cuff in athletes and non-athletes: Retrospective study. Int J Surg. 2018;51:184-90.
-
55Lin MT, Chiang CF, Wu CH, Huang YT, Tu YK, Wang TG. Comparative Effectiveness of Injection Therapies in Rotator Cuff Tendinopathy: A Systematic Review, Pairwise and Network Meta-analysis of Randomized Controlled Trials. Arch Phys Med Rehabil. 2019;100(2):336-49 e315.
-
56Paavola M, Kannus P, Jarvinen TA, Jarvinen TL, Jozsa L, Jarvinen M. Treatment of tendon disorders. Is there a role for corticosteroid injection? Foot Ankle Clin. 2002;7(3):501-13.
-
57Lin KM, Wang D, Dines JS. Injection Therapies for Rotator Cuff Disease. Orthop Clin North Am. 2018;49(2):231-9.
-
58Dean BJ, Lostis E, Oakley T, Rombach I, Morrey ME, Carr AJ. The risks and benefits of glucocorticoid treatment for tendinopathy: a systematic review of the effects of local glucocorticoid on tendon. Semin Arthritis Rheum. 2014;43(4):570-6.
-
59Hurley ET, Lim Fat D, Moran CJ, Mullett H. The Efficacy of Platelet-Rich Plasma and Platelet-Rich Fibrin in Arthroscopic Rotator Cuff Repair: A Meta-analysis of Randomized Controlled Trials. Am J Sports Med. 2018:363546517751397.
-
60Filardo G, Di Matteo B, Kon E, Merli G, Marcacci M. Platelet-rich plasma in tendon-related disorders: results and indications. Knee Surg Sports Traumatol Arthrosc. 2018;26(7):1984-99.
-
61Carr JB 2nd, Rodeo SA. The role of biologic agents in the management of common shoulder pathologies: current state and future directions. J Shoulder Elbow Surg. 2019;28(11):2041-52.
-
62Jo CH, Lee SY, Yoon KS, Shin S. Effects of Platelet-Rich Plasma With Concomitant Use of a Corticosteroid on Tenocytes From Degenerative Rotator Cuff Tears in Interleukin 1beta-Induced Tendinopathic Conditions. Am J Sports Med. 2017;45(5):1141-50.
-
63Reeves KD, Sit RW, Rabago DP. Dextrose Prolotherapy: A Narrative Review of Basic Science, Clinical Research, and Best Treatment Recommendations. Phys Med Rehabil Clin N Am. 2016;27(4):783-823.
-
64Catapano M, Zhang K, Mittal N, Sangha H, Onishi K, de Sa D. Effectiveness of Dextrose Prolotherapy for Rotator Cuff Tendinopathy: A Systematic Review. PM R. 2020;12(3):288-300.
-
65Bertrand H, Reeves KD, Bennett CJ, Bicknell S, Cheng AL. Dextrose Prolotherapy Versus Control Injections in Painful Rotator Cuff Tendinopathy. Arch Phys Med Rehabil. 2016;97(1):17-25.
-
66Karthikeyan S, Kwong HT, Upadhyay PK, Parsons N, Drew SJ, Griffin D. A double-blind randomised controlled study comparing subacromial injection of tenoxicam or methylprednisolone in patients with subacromial impingement. J Bone Joint Surg Br. 2010;92(1):77-82.
-
67Aksakal M, Ermutlu C, Ozkaya G, Ozkan Y. Lornoxicam injection is inferior to betamethasone in the treatment of subacromial impingement syndrome: a prospective randomized study of functional outcomes. Orthopade. 2017;46(2):179-85.
-
68Wu T, Fu Y, Song HX, Ye Y, Dong Y, Li JH. Effectiveness of Botulinum Toxin for Shoulder Pain Treatment: A Systematic Review and Meta-Analysis. Arch Phys Med Rehabil. 2015;96(12):2214-20.
-
69Vandvik PO, Lahdeoja T, Ardern C, et al. Subacromial decompression surgery for adults with shoulder pain: a clinical practice guideline. BMJ. 2019;364:l294.
-
70Ketola S, Lehtinen JT, Arnala I. Arthroscopic decompression not recommended in the treatment of rotator cuff tendinopathy: a final review of a randomised controlled trial at a minimum follow-up of ten years. Bone Joint J. 2017;99-B(6):799-805.
-
71Meislin R. Editorial Commentary: #Fakeradiographicangle-Critical Shoulder Angle, Like Acromioplasty, May Not Be Critical. Arthroscopy. 2019;35(11):3144-5.
-
72Al-Ani Z, Jacobsen EW, Kartus JT, Knutsen G, Meknas K. Radiofrequency microtenotomy: a promising method for treatment of rotator cuff tendinopathy. Knee Surg Sports Traumatol Arthrosc. 2019;27(12):3856-63.
-
73Taverna E, Battistella F, Sansone V, Perfetti C, Tasto JP. Radiofrequency-based plasma microtenotomy compared with arthroscopic subacromial decompression yields equivalent outcomes for rotator cuff tendinosis. Arthroscopy. 2007;23(10):1042-51.
-
74Oliva F, Piccirilli E, Bossa M, et al. I.S.Mu.L.T - Rotator Cuff Tears Guidelines. Muscles Ligaments Tendons J. 2015;5(4):227-63.
-
75Zhang T, Duan Y, Chen J, Chen X. Efficacy of ultrasound-guided percutaneous lavage for rotator cuff calcific tendinopathy: a systematic review and meta-analysis. Medicine (Baltimore). 2019;98(21):e15552.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- La lesión de tendón, del eterno olvidado a una patología de moda
- Fisiología y mecanobiología del tejido tendinoso y muscular
- Tendinopatía rotuliana: diagnóstico ecográfico y por resonancia magnética. Alternativas de tratamiento conservador y quirúrgico
- Fisiopatología, diagnóstico y tratamiento de la tendinopatía aquílea
- Tendinopatía del supraespinoso: diagnóstico ecográfico y por resonancia magnética. Alternativas de tratamiento conservador y quirúrgico
- Resultados de reparación artroscópica de tendón glúteo medio en pacientes afectos de síndrome de dolor trocantérico. Serie de casos
- Actualización en el diagnóstico y el tratamiento de las lesiones musculares del cuádriceps
- Manejo de las lesiones musculares del tríceps sural en deportistas adultos jóvenes y de mediana edad: revisión narrativa de la literatura
- Tendinopatía insercional del tendón de Aquiles. Tratamiento de principio a fin
- Cíclope invertido
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.