Edema óseo y fracturas trabeculares en la rodilla: ¿se pueden tratar?
Bone marrow edema and subchondral fractures around the knee: can we treat them?
Resumen:
El edema óseo es un cuadro clínico doloroso, inespecífico, que puede presentarse asociado a multitud de causas y etiopatogenias diferentes. Su evolución es igualmente variable, desde lesiones reversibles y de curso autolimitado, hasta lesiones con evolución progresiva y destrucción articular. La prueba diagnóstica de elección es la resonancia magnética, donde muestra señal hipointensa en T1 e hiperintensa en T2, y cuya distribución puede ser de ayuda para dilucidar la causa primaria que genera el edema. El tratamiento de elección inicial es conservador, mediante medidas físicas y farmacológicas, reservando la cirugía para aquellos casos que no muestran respuesta tras 3 meses o que presentan lesiones de gran tamaño con tendencia al colapso.
Abstract:
A bone marrow edema consists of an unspecific clinical feature which presents pain and can be associated with many different causes and pathogenesis. Its clinical evolution varies from self-limited and reversible lesions to progressive and destructive ones. Magnetic resonance imaging is the preferred diagnostic test, on which bone edema can be identified as hypointense on T1 and hyperintense on T2. The distribution of the lesions on images can be helpful in clarifying its origin. Initially, non surgical treatment is the one recommended, by applying physical measures and medical treatment. Surgery is considered only in case there is no response after 3 months of conservative treatment or for those who present with high volume lesions that tend to collapse.
Introducción
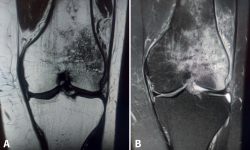
El concepto de edema óseo fue descrito por primera vez por Wilson en 1988(1), como un cuadro clínico doloroso que muestra en la imagen de resonancia magnética (RM) una señal hipointensa en las secuencias T1 e hiperintensa en las T2 (Figura 1), y fue interpretado como un aumento del contenido de agua en la médula ósea. Posteriormente, aparecieron otros términos en la literatura que hacían referencia a imágenes superponibles en RM a las descritas por Wilson, como “síndrome de edema óseo transitorio” u “osteoporosis transitoria”. Actualmente, se considera más correcto emplear el término “lesiones de médula ósea”, que engloba un amplio grupo de condiciones clínicas que comparten el dolor como síntoma principal e imagen similar en la RM, pero con gran variabilidad etiopatogénica e histológica.
El edema óseo es un factor de riesgo conocido para la progresión a daño articular(2,3), por lo que su diagnóstico precoz y el tratamiento de la causa subyacente resultan fundamentales.
A modo representativo, presentamos un caso clínico de un varón de 53 años, de profesión camionero, con antecedentes personales de dislipemia y sobrepeso (índice de masa corporal –IMC– de 31), que presentó un traumatismo con mecanismo de pivotaje sobre su rodilla derecha al bajar del camión, con sensación de chasquido, que evolucionó con intenso dolor e inflamación progresiva en las horas siguientes al traumatismo.
retla.05210.fs2208018-figura2.png
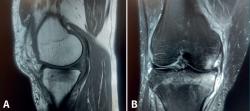
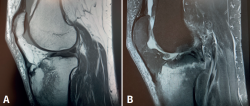
Figura 2. Resonancia magnética de rodilla derecha. A: corte sagital, secuencia potenciada en T1 que muestra edema en la meseta tibial medial, con señal hipointensa; B: corte coronal, secuencia potenciada en T2, que muestra extrusión del cuerpo del menisco interno, asociada a intenso edema en la meseta tibial interna, con señal hiperintensa.
Acudió inicialmente al Servicio de Urgencias, presentando dolor en reposo, que se intensificaba con la carga sobre la rodilla, limitando la deambulación e impidiendo el uso de escaleras. En la exploración física presentaba derrame articular moderado, sin deformidad grosera, con un déficit de extensión de los últimos 10° y flexión limitada a 90°, dolor intenso a la palpación sobre la interlínea articular medial, la meseta tibial interna y la inserción distal de los isquiotibiales. No se objetivó inestabilidad ligamentosa y las maniobras meniscales fueron no valorables por intenso dolor y escasa flexión.
En la radiografía simple no presentaba lesiones óseas agudas y se realizó artrocentesis, extrayendo 60 mL de líquido articular de características inflamatorias, moderadamente hemático, sin sobrenadante graso.
Se colocó vendaje compresivo de rodilla, indicando reposo, carga parcial con bastones ingleses, aplicación de frío local y toma de antiinflamatorios no esteroideos.
A las 2 semanas de evolución, el paciente continúa presentando dolor moderado localizado en el compartimento femorotibial interno, con derrame articular leve y maniobras meniscales internas positivas. En la RM se objetiva edema óseo en la meseta tibial interna y la región distal del cóndilo femoral interno, asociado a una rotura-avulsión de la raíz posterior del menisco interno (Figura 2). Se le indica apoyo limitado con 2 bastones e inicio de tratamiento rehabilitador.
A las 3 semanas de evolución, persiste el dolor con la mínima carga (puntuación en la escala visual analógica –EVA– de 9/10), no pudiendo retirar los bastones para caminar e impidiendo el uso de escaleras, por lo que se decide realizar infiltraciones intraarticulares, inicialmente 2 corticoanestésicas y posteriormente viscosuplementación con ácido hialurónico, sin mejoría clínica.
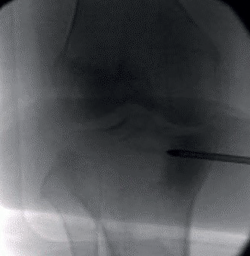
Ante la no respuesta al tratamiento conservador, se decide la intervención quirúrgica los 3 meses y medio de evolución, realizándose, bajo anestesia raquídea y control escópico intraoperatorio, una técnica de subcondroplastia, inyectando 5 mL de matriz ósea desmineralizada (DBM) con plasma rico en plaquetas (PRP), obtenido de sangre periférica del paciente, a través de una broca canulada de 4,5 mm a nivel subcondral en la meseta tibial medial (Figura 3).
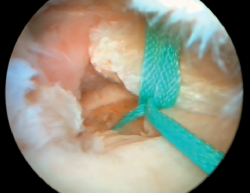
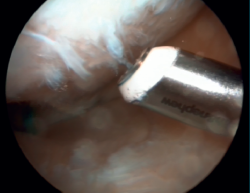
Posteriormente, se realizó artroscopia de la rodilla derecha, a través de los portales anterolateral y anteromedial convencionales, comprobando que no existía extravasación intraarticular de DBM, y se reinsertó la raíz posterior del menisco interno con una sutura transósea a la tibia (Figura 4). Se objetivaron asimismo lesiones condrales de grado III en el cóndilo femoral interno, que se desbridaron con un terminal de radiofrecuencia (Figura 5).
Se indicó descarga absoluta durante las primeras 4 semanas postoperatorias, bajo tratamiento tromboprofiláctico con heparina de bajo peso molecular, y ejercicios suaves con restricción de la flexión a 90°. Transcurridas las primeras 4 semanas, inició carga progresiva con bastones y rehabilitación, consiguiendo retirar los bastones a las 8 semanas postoperatorias.
A los 3 meses postoperatorios el paciente presenta dolor leve (EVA de 3/10) con la carga en la cara medial de la articulación, es capaz de deambular sin bastones, sube y baja escaleras. En la exploración física no presenta derrame articular, con un rango de movilidad de 0-145°.
A los 8 meses de evolución postoperatoria la intensidad del dolor aún es leve (EVA de 3/10), pero persiste la impotencia funcional para la carga en flexión (posición de cuclillas).
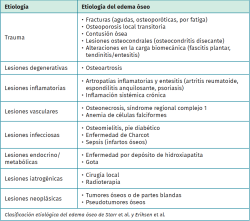
Etiología del edema óseo
Existen multitud de causas que pueden dar lugar a la aparición de edema en la médula ósea y su diagnóstico resulta crucial, ya que el éxito depende del tratamiento de la causa que lo origina. Starr et al.(4) y posteriormente Eriksen y Ringe(5) propusieron una clasificación etiológica de las enfermedades que pueden cursar con edema óseo (Tabla 1). Además, existen síndromes de edema óseo primario, en los que la causa que origina el edema es desconocida.
También podemos clasificar las causas que originan el edema óseo en 3 grandes grupos, según su mecanismo de producción.
Edema óseo de origen mecánico
retla.05210.fs2208018-figura6.png
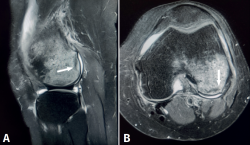
Figura 6. Resonancia magnética de rodilla, secuencias potenciadas en T2. A: corte sagital; B: corte axial. Se aprecia intenso edema óseo en el cóndilo femoral externo, con señal hiperintensa, e imagen de fractura trabecular subcondral como una línea hipointensa paralela a la superficie articular (flecha).
El origen traumático es la causa más frecuente de edema óseo. El impacto directo sobre el hueso subcondral puede generar fracturas trabeculares, que se presentan como imágenes lineales paralelas a la superficie articular, hipointensas en T2 (Figura 6). Se han descrito diferentes patrones de distribución del edema óseo, según el mecanismo traumático:
- Mecanismo de pivotaje, asociado frecuentemente a roturas del ligamento cruzado anterior, con edema óseo en el cóndilo femoral lateral y la zona posterior de los platillos tibiales (Figura 7).
- Mecanismo de hiperextensión, asociado a roturas del ligamento cruzado posterior, el edema se distribuye en la parte más anterior de los cóndilos femorales y los platillos tibiales (Figura 8).
- Lesión del salpicadero, por contusión directa anterior y formación de edema óseo en la zona más anterior de cóndilos y platillos tibiales.
- Luxaciones de rótula, con imagen de edema óseo en la zona más lateral del cóndilo femoral lateral y en la faceta medial rotuliana (Figura 9).
- Mecanismos de compresión axial, con distribución del edema en la región de carga subcondral, con formación o no de fracturas subcondrales.
Además, una carga mecánica anómala sobre el hueso subcondral puede originar también la aparición de edema óseo, por un mecanismo de microtraumatismo repetitivo, como en las alteraciones de la alineación de la extremidad, la osteoartrosis, o en la fase subaguda y crónica de las roturas ligamentosas y/o meniscales (Figura 10).
retla.05210.fs2208018-figura7.png
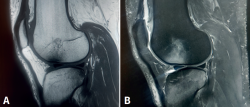
Figura 7. Resonancia magnética de rodilla, cortes sagitales, con rotura del ligamento cruzado anterior. A: secuencia potenciada en T1, se aprecia edema óseo con señal hipointensa en el cóndilo femoral externo y en la zona posterior del platillo tibial; B: secuencia potenciada en T2, se aprecia edema óseo con la misma distribución, pero señal hiperintensa.
Edema óseo de origen isquémico
Este grupo engloba diferentes entidades que cursan con una disminución de la perfusión ósea, como:
- Osteonecrosis o necrosis avascular (NAV): más frecuente en mujeres, generalmente mayores de 45 años, con lesiones múltiples, frecuentemente bilaterales. Asociada al consumo de alcohol o corticoterapia en el 90% de los casos, pero también a enfermedades metabólicas como enfermedad de Gaucher o anemia de células falciformes.
- Osteonecrosis espontánea de la rodilla: también más frecuente en el sexo femenino, pero en mayores de 60 años, se presenta como una lesión única, generalmente en el cóndilo femoral interno y no suelen identificarse factores de riesgo desencadenantes.
- Osteonecrosis postartroscopia: hasta el 34% de los pacientes tratados artroscópicamente pueden presentar focos de necrosis, generalmente autolimitados.
- Osteonecrosis disecante: necrosis subcondral idiopática que se presenta típicamente en adolescentes varones, más frecuente en el cóndilo femoral interno.
- Síndrome de dolor regional complejo: generado por una respuesta simpática anormal a traumatismos o cirugías.
Edema óseo reactivo
El edema óseo aparece como respuesta inflamatoria a diferentes procesos, con un aumento de la vascularización del hueso subcondral: osteomielitis, artritis séptica, tumores benignos (osteoma osteoide, osteoblastoma) y malignos (sarcoma de Ewing, osteosarcoma, condroblastoma) y metástasis. Las artritis inflamatorias (artritis reumatoide, gota) también pueden generar edema óseo, constituyendo este un factor de mal pronóstico para el desarrollo de erosiones progresivas y lesión condral.
Diagnóstico del edema óseo
El edema óseo per se no presenta hallazgos característicos en las pruebas de imagen de radiología simple, ni en tomografía axial computarizada, pero pueden ser útiles en el diagnóstico de la causa etiológica.
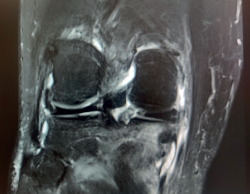
La RM es la prueba de imagen de elección para su diagnóstico, en la cual se muestra como una lesión de bordes mal definidos, que sobrepasa las cicatrices fisarias y que puede extenderse a las partes blandas adyacentes, con señal hipointensa en las secuencias potenciadas en T1 e hiperintensa en las secuencias T2, con supresión grasa y STIR (short tau inversion recovery)(6). Además, la imagen de RM puede revelar la presencia de fracturas trabeculares por impactación del hueso subcondral y hundimiento del cartílago suprayacente, que se presentan como líneas hipointensas en T2, paralelas a la superficie articular. Las lesiones por NAV presentan un patrón típico en la imagen de RM, con un borde serpenteado y presencia de doble contorno hiperintenso e hipointenso en las secuencias T2 (Figura 11).
retla.05210.fs2208018-figura11.png
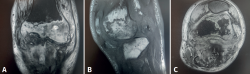
Figura 11. Resonancia magnética de rodilla, que presenta luxación femorotibial inveterada, de 7 meses de evolución, en la que se aprecian focos de osteonecrosis avascular, con bordes serpenteados e intenso edema óseo circundante. A: corte coronal, secuencia T2; B: corte sagital, secuencia T1; C: corte axial, secuencia con supresión grasa.
Histopatología del edema óseo
La histología de las lesiones que cursan con edema óseo presenta zonas con infiltración inflamatoria, fibrosis, así como áreas de necrosis grasa y hemorrágicas asociadas a microfracturas del hueso trabecular, en diferentes proporciones en función de su etiología(7). Estos cambios histopatológicos generan un aumento de la presión intraósea, que conlleva una disminución de la perfusión, aumentando aún más la hipoxia y los fenómenos de necrosis y reduciendo la mineralización y el potencial de consolidación.
Existen diversas teorías sobre cuál es el mecanismo que genera el dolor, pero es posible que el aumento de la presión intraósea en el foco del edema óseo estimule los receptores de glutamato presentes en las estructuras neurológicas adyacentes. Asimismo, los procesos de hipoxia y acidosis local producen liberación de mediadores inflamatorios (prostaglandinas y citocinas) que generan mayor hiperemia y congestión, irritando el periostio y estructuras periarticulares(8).
Evolución y pronóstico
Al igual que su etiología, la evolución del edema óseo es muy variable. Existen lesiones reversibles, con un curso autolimitado, que desaparecen sin dejar secuelas en 6-12 meses, como la osteoporosis transitoria, el síndrome regional complejo y la mayor parte de los edemas óseos traumáticos(9). Sin embargo, cuando el edema óseo aparece asociado a osteoartrosis o artritis reumatoide, la evolución hacia la formación de erosiones condrales y la destrucción articular es más frecuente(3). La evolución de las lesiones con un origen isquémico parece estar en relación con su tamaño; así, las lesiones menores de 3,5 cm2 suelen evolucionar hacia la reversibilidad, mientras que las mayores de 5 cm2 frecuentemente sufren colapso del hueso subcondral y destrucción articular(10).
Tratamiento del edema óseo
Dado que el edema óseo es una situación clínica que puede aparecer asociada a múltiples patologías de diferente etiología, el objetivo del tratamiento debe dirigirse a la causa primaria que genera el edema. Sin embargo, es posible modificar la evolución del edema óseo con medidas físicas y farmacológicas, reservando la cirugía para aquellos casos en los que la evolución no sea satisfactoria con tratamiento conservador(11).
Entre las medidas físicas más utilizadas figuran la restricción de la carga sobre la articulación durante 4-6 semanas y la protección de esta durante periodos entre 3 y 6 meses, mediante el uso de ortesis de descarga del compartimento afectado. La actividad física o deportiva debe restringirse durante los primeros 6 meses. Otras terapias físicas empleadas para reducir el tiempo de evolución del edema óseo son: terapia con pulsos electromagnéticos, que reduce la inflamación y estimula la formación de hueso por los osteoblastos(12); terapia con ondas de choque extracorpóreas, con propiedades antiinflamatorias y angiogénicas(13); y terapia con oxígeno hiperbárico, por sus propiedades angiogénicas.
Los fármacos más utilizados en el tratamiento del edema óseo son los analgésicos y antiinflamatorios no esteroideos, seguidos de infiltraciones intraarticulares con corticoides o viscosuplementación con ácido hialurónico, como tratamiento sintomático. El uso de bisfosfonatos (alendronato, ibandronato) inhibe los osteoclastos, favoreciendo la formación de hueso, y pueden resultar útiles en la reducción de los síntomas y en la mejoría de la función de la articulación, disminuyendo ligeramente la tasa de colapso del hueso subcondral(14). También se han utilizado prostaciclinas (iloprost) por su efecto vasodilatador y antiagregante plaquetario, que parecen tener eficacia en la reducción del área de edema, mejorando la sintomatología.
El tratamiento quirúrgico debe reservarse para aquellos casos en los que no exista una respuesta al tratamiento conservador durante al menos 3 meses o bien en aquellos casos en los que existe un área de edema crónico sin una causa subyacente tratable o focos de osteonecrosis de gran tamaño con tendencia al colapso.
Los objetivos del tratamiento quirúrgico son:
- Disminuir la presión intraósea: descompresión del foco.
- Dar soporte al hueso subcondral: subcondroplastia con fosfato cálcico.
- Estimular la formación de hueso: subcondroplastia con aporte biológico.
La descompresión del foco de edema es una técnica sencilla, con baja morbilidad, que consiste en brocar orificios múltiples bajo control radioscópico, para disminuir la presión intraósea y favorecer el flujo vascular. Es recomendable limitar la carga de peso durante las primeras 4-6 semanas postoperatorias.
La técnica de subcondroplastia con fosfato cálcico realiza descompresión del foco con una broca canulada y fenestrada, a través de la cual se inyecta un sustitutivo óseo sintético bajo control radioscópico, para dar soporte al área subcondral(15). El fosfato cálcico actúa como una matriz osteoconductiva y se reabsorbe una vez formado el nuevo hueso, permitiendo su remodelado. Debe evitarse la extravasación de fosfato cálcico al espacio articular (es recomendable realizar una artroscopia de comprobación tras su inyección en el hueso subcondral) y no precisa de inmovilización postoperatoria, permitiéndose la carga según la tolerancia en el postoperatorio inmediato. La inyección de fosfato cálcico subcondral no limita posibles tratamientos quirúrgicos en un futuro, como osteotomías de corrección del eje o prótesis de rodilla.
La subcondroplastia con aporte biológico realiza también descompresión del foco con una broca canulada y fenestrada, pero se inyecta en el área subcondral injerto óseo o DBM suplementado con concentrado de aspirado de médula ósea (obtenido de cresta ilíaca anterior) o de PRP (obtenido de sangre periférica)(16). Este aporte biológico tiene propiedades osteoconductivas, osteoinductivas y osteogénicas, favoreciendo la formación de nuevo hueso en el área subcondral y osteointegrándose, por lo que tampoco limita posibles tratamientos quirúrgicos futuros. Durante el postoperatorio se inmoviliza en extensión y se limita la carga durante las primeras 3 semanas.
Las técnicas quirúrgicas de subcondroplastia muestran resultados clínicamente relevantes en cuanto a mejoría de la sintomatología dolorosa y la funcionalidad de la articulación, con una baja tasa de complicaciones (infecciones locales, dolor en la zona de punción, rotura del trocar) y con una tasa baja de conversión a prótesis de rodilla a corto plazo (10% en el primer año; 30% a los 2 años)(15,16,17)., sin embargo, el nivel de evidencia disponible con los estudios realizados actualmente continúa siendo bajo, por lo que serían precisos estudios de mayor calidad para poder incorporar estos procedimientos a nuestra práctica clínica habitual.
En el caso clínico que hemos presentado a modo de introducción, el paciente mostraba en la RM un edema óseo de origen mecánico, localizado fundamentalmente en la meseta tibial medial, asociado a una avulsión de la raíz posterior del menisco interno y a cambios degenerativos condrales de grado III en el compartimento femorotibial interno. Inicialmente, se optó por tratamiento conservador, que resultó no ser efectivo, por lo que se decidió intervenir quirúrgicamente a los 3 meses y medio de evolución, combinando una técnica de subcondroplastia mediante inyección subcondral de DBM con PRP en la meseta tibial medial y una reinserción artroscópica de la raíz posterior del menisco interno mediante una sutura transósea a la tibia.
En la valoración postoperatoria se documentó mejoría del dolor y de la limitación funcional iniciales, que se mantiene a los 8 meses de evolución postoperatoria; sin embargo, aún persistía dolor de intensidad leve y limitación para la carga en flexión, evitándose hasta la actualidad la necesidad de nuevas intervenciones quirúrgicas.
Conclusiones
El edema óseo es un cuadro clínico doloroso muy frecuente, que puede presentarse asociado a múltiples causas. Su evolución es muy variable, pudiendo resolverse de forma espontánea y completa o evolucionando hacia la progresión de erosiones condrales y destrucción articular. Es fundamental, por lo tanto, realizar un diagnóstico precoz e instaurar el tratamiento adecuado de la causa que lo origina, siempre que sea posible. El tratamiento inicial es conservador, reservando la cirugía para aquellos casos en los que no se aprecia mejoría tras al menos 3 meses o bien en aquellos que presentan lesiones osteonecróticas de gran tamaño con mayor tendencia al colapso.
Figuras
Figura 1. Cortes coronales de resonancia magnética de rodilla izquierda con edema óseo de origen traumático. A: en las secuencias potenciadas en T1 el edema óseo presenta una señal hipointensa; B: en las secuencias potenciadas en T2, presenta una señal hiperintensa.
Figura 2. Resonancia magnética de rodilla derecha. A: corte sagital, secuencia potenciada en T1 que muestra edema en la meseta tibial medial, con señal hipointensa; B: corte coronal, secuencia potenciada en T2, que muestra extrusión del cuerpo del menisco interno, asociada a intenso edema en la meseta tibial interna, con señal hiperintensa.
Figura 3. Control escópico intraoperatorio de técnica de subcondroplastia en la meseta tibial medial.
Figura 4. Imagen artroscópica de reinserción de la raíz posterior del menisco interno mediante sutura transósea a la tibia.
Figura 5. Imagen artroscópica de desbridamiento de lesiones condrales de grado III en el cóndilo femoral interno utilizando un terminal de radiofrecuencia.
Figura 6. Resonancia magnética de rodilla, secuencias potenciadas en T2. A: corte sagital; B: corte axial. Se aprecia intenso edema óseo en el cóndilo femoral externo, con señal hiperintensa, e imagen de fractura trabecular subcondral como una línea hipointensa paralela a la superficie articular (flecha).
Figura 7. Resonancia magnética de rodilla, cortes sagitales, con rotura del ligamento cruzado anterior. A: secuencia potenciada en T1, se aprecia edema óseo con señal hipointensa en el cóndilo femoral externo y en la zona posterior del platillo tibial; B: secuencia potenciada en T2, se aprecia edema óseo con la misma distribución, pero señal hiperintensa.
Figura 8. Resonancia magnética de rodilla, cortes sagitales, con rotura del ligamento cruzado posterior, se aprecia edema óseo en la parte más anterior de los platillos tibiales por mecanismo de hiperextensión. A: secuencia potenciada en T1; B: secuencia potenciada en T2.
Figura 9. Resonancia magnética de rodilla tras una luxación rotuliana lateral, corte axial, secuencia potenciada en T2, que muestra edema óseo en el aspecto más lateral del cóndilo femoral externo y en el borde medial de la rótula.
Figura 10. Resonancia magnética de rodilla, corte coronal, secuencia potenciada en T2, que muestra una rotura-avulsión de la raíz posterior del menisco interno, con edema óseo mecánico por sobrecarga del platillo tibial medial.
Figura 11. Resonancia magnética de rodilla, que presenta luxación femorotibial inveterada, de 7 meses de evolución, en la que se aprecian focos de osteonecrosis avascular, con bordes serpenteados e intenso edema óseo circundante. A: corte coronal, secuencia T2; B: corte sagital, secuencia T1; C: corte axial, secuencia con supresión grasa.
Tablas
Información del artículo
Cita bibliográfica
Autores
Laura Suárez Arias
Unidad de Rodilla. Servicio de Traumatología. Ibermutua. Madrid
Gabriel López Graña
Unidad de Rodilla. Servicio de Traumatología. Ibermutua. Madrid
Enrique Sandoval Rodríguez
Unidad de Rodilla. Servicio de Traumatología. Ibermutua. Madrid
Servicio de Traumatología y Cirugía Ortopédica. IIS-Fundación Jiménez Díaz. Universidad Autónoma de Madrid
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Wilson AJ, Murphy WA, Hardy DC, Totty WG. Transient osteoporosis: transient bone marrow edema? Radiology. 1988 Jun;167(3):757-60.
-
2Roemer FW, Guermazi A, Javaid MK, Lynch JA, Niu J, Zhang Y, et al.; MOST Study investigators. Change in MRI-detected subchondral bone marrow lesions is associated with cartilage loss: the MOST Study. A longitudinal multicentre study of knee osteoarthritis. Ann Rheum Dis. 2009 Sep;68(9):1461-5.
-
3Tanamas SK, Wluka AE, Pelletier JP, Pelletier JM, Abram F, Berry PA, et al. Bone marrow lesions in people with knee osteoarthritis predict progression of disease and joint replacement: a longitudinal study. Rheumatology (Oxford). 2010 Dec;49(12):2413-9.
-
4Starr AM, Wessely MA, Albastaki U, Pierre-Jerome C, Kettner NW. Bone marrow edema: Pathophysiology, differential diagnosis and imaging. Acta Radiol. 2008;49:771-86.
-
5Eriksen EF, Ringe JD. Bone marrow lesions: A universal bone response to injury? Rheumatol Int. 2012;32:575-84.
-
6Korompilias AV, Karantanas AH, Lykissas MG, Beris AE. Bone marrow edema syndrome. Skeletal Radiol. 2009 May;38(5):425-36.
-
7Taljanovic MS, Graham AR, Benjamin JB, Gmitro AF, Krupinski EA, Schwartz SA, et al. Bone marrow edema pattern in advanced hip osteoarthritis: quantitative assessment with magnetic resonance imaging and correlation with clinical examination, radiographic findings, and histopathology. Skeletal Radiol. 2008 May;37(5):423-31.
-
8Uchio Y, Ochi M, Adachi N, Nishikori T, Kawasaki K. Intraosseus hypertension and venous congestion in osteonecrosis of the knee. Clin Orthop Relat Res. 2001:217-23.
-
9Costa-Paz M, Muscolo DL, Ayerza M, Makino A, Aponte-Tinao L. Magnetic resonance imaging follow-up study of bone bruises associated with anterior cruciate ligament ruptures. Arthroscopy. 2001;17(5):445-9.
-
10Mont MA, Marker DR, Zywiel MG, Carrino JA. Osteonecrosis of the knee and related conditions. J Am Acad Orthop Surg. 2011;19(8):482-94.
-
11Akhavan S, Martinkovich SC, Kasik C, DeMeo PJ. Bone marrow edema, clinical significance and treatment options: a review. J Am Acad Orthop Surg. 2020 October;28:888-99.
-
12Tarantino U, Greggi C, Cariati I, Caldora P, Capanna R, Capone A, et al. Bone Marrow Edema: Overview of Etiology and Treatment Strategies. J Bone Joint Surg Am. 2022 Jan 19;104(2):189-200.
-
13Häusser J, Wieber J, Catalá-Lehnen P. The use of extracorporeal shock wave therapy for the treatment of bone marrow oedema: a systematic review and metaanalysis. J Orthop Surg Res. 2021;16:369.
-
14Simon MJ, Barvencik F, Luttke M, Amling M, Mueller-Wohlfahrt HW, Ueblacker P. Intravenous bisphosphonates and vitamin D in the treatment of bone marrow oedema in professional athletes. Injury. 2014 Jun;45(6):981-7.
-
15Nairn LN, Subramaniam M, Ekhtiari S, Axelrod DE, Grant JA, Khan M. Safety and early results of Subchondroplasty® for the treatment of bone marrow lesions in osteoarthritis: a systematic review. Knee Surg Sports Traumatol Arthrosc. 2021 Nov;29(11):3599-607.
-
16Kasik CS, Martinkovich S, Mosier B, Akhavan S. Short-Term Outcomes for the Biologic Treatment of Bone Marrow Edema of the Knee Using Bone Marrow Aspirate Concentrate and Injectable Demineralized Bone Matrix. Arthrosc Sports Med Rehabil. 2019 Aug 26;1(1):e7-e14.
-
17Chua K, Kang JYB, Ng FDJ, Pang HN, Lie DTT, Silva A, Chang PCC. Subchondroplasty for Bone Marrow Lesions in the Arthritic Knee Results in Pain Relief and Improvement in Function. J Knee Surg. 2021 May;34(6):665-71.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Recogiendo el testigo
- Gigantes
- Fracturas de la meseta tibial en el ángulo posterolateral y posteromedial
- Tratamiento de las fracturas de espina tibial anterior aislada. Indicación y técnicas de fijación
- Manejo de las fracturas osteocondrales de la rodilla
- Papel de la fijación externa en fracturas de meseta tibial
- Edema óseo y fracturas trabeculares en la rodilla: ¿se pueden tratar?
- ¿Cómo evitar la hipotrofia tras la inmovilización?
- Fractura tibial por explosivo: a propósito de un caso
- Análisis de las demandas sobre temas médicos presentadas en los juzgados de lo social en la ciudad de Cartagena contra una mutua de accidente laboral en los años 2012, 2013 y 2014
- Incapacidad laboral en el paciente con una amputación de un miembro superior
- Lesión de Stener en el medio laboral
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Traumatología Laboral está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.