Osteítis crónica
Chronic osteitis
Resumen:
Las enfermedades infecciosas de los huesos constituyen una complicación importante en el campo de la traumatología y la cirugía ortopédica, pudiéndose diferenciar entre osteomielitis y osteítis.
El objetivo del tratamiento va encaminado a resolver la infección y a intentar mantener la funcionalidad de los huesos y articulaciones adyacentes, disminuyendo al máximo las posibles discapacidades.
Para lograr estos objetivos el tratamiento de las infecciones óseas se basa en 2 prioridades u objetivos fundamentales: la erradicación de la infección y la reconstrucción del hueso y de las partes blandas adyacentes.
De este modo, el tratamiento quirúrgico con resección de los segmentos óseos y tejidos blandos afectados, la oclusión de la cavidad residual, seguido de métodos reconstructivos tanto óseos como de partes blandas, y el tratamiento antibiótico constituyen las bases del tratamiento.
Abstract:
Infectious bone diseases are one of the main complications in the traumatology and orthopaedic surgery fields. There are two types of such diseases: osteomyelitis and osteitis.
Treatment’s goal is addressed to heal the infection and to maintain adjacent bones and joints’ function, minimizing possible disabilities.
Bone infections’ treatment aims to achieve 2 main priorities or objectives: infection eradication and bone and adjacent soft tissues reconstruction.
This way, treatment is based on surgery with resection of the affected bone segments and soft tissues and residual cavity occlusion, then followed by reconstruction of both bone and soft tissues and antibiotic treatment.
Introducción
El término osteítis séptica se refiere a una infección ósea causada principalmente por bacterias que pueden llevar a la destrucción completa del hueso infectado, pero también de los tejidos blandos circundantes. No siempre la literatura médica realiza una clara diferenciación entre osteítis y osteomielitis. Usando criterios anatomopatológicos y patológicos, habría que distinguir, por un lado, entre osteomielitis hematógena aguda y crónica y, por otra parte, entre osteítis exógena aguda y crónica (postraumática o posquirúrgica).
La osteomielitis sería una infección primaria de la médula ósea que afectaría posteriormente al hueso cortical, periostio y partes blandas, con una diseminación centrífuga desde dentro hacia afuera. Se puede producir por diseminación hematógena de los gérmenes, adquirida a partir de un foco infeccioso contiguo, o bien por inoculación directa en el hueso. La osteomielitis se puede clasificar en aguda, subaguda y crónica.
La osteítis se produce por infección del hueso secundaria a cirugía o bien a traumatismos con heridas que exponen el hueso, pudiendo afectar posteriormente a la médula ósea, con lo cual tendría una diseminación centrípeta desde fuera hacia dentro.
Se han descrito diferentes sistemas de clasificación en la literatura médica. En general, se recomienda la clasificación de Waldvogel(1) y la de Cyerni y Madel(2), que tienen en cuenta los parámetros analizados anteriormente.
Hofman(3) distingue entre osteítis agudas y crónicas. La aguda se produciría durante las primeras 8 semanas posteriores a la cirugía o al traumatismo. La osteítis crónica sería la que se produciría a partir de las 8 semanas, siendo consecuencia de la prolongación de un proceso agudo no resuelto o bien la recidiva de un proceso agudo ya tratado e inicialmente resuelto.
De este modo, el propósito de este trabajo y lo que se analizará a partir de ahora será el estudio de la osteítis exógena crónica de origen postraumático y posquirúrgico, en los casos en que se haya conseguido la consolidación de la fractura y excluyendo los casos de pseudoartrosis séptica.
El tratamiento de las osteítis crónicas sigue los principios de la cirugía oncológica, basada en la eliminación quirúrgica radical del hueso y los tejidos blandos afectos, seguida de terapia adyuvante con antibióticos por vía sistémica y local.
A pesar de aplicar métodos radicales, en ocasiones no se consigue eliminar totalmente la infección, quedando esta silente y pudiendo recidivar incluso años después. Es lo que se conoce como “secado” de la infección.
Existen factores que pueden predisponer a la infección ósea, ya sean sistémicos o locales, entre los que se encuentran la edad avanzada, la obesidad, el tabaquismo, el alcoholismo, la diabetes, las enfermedades vasculares, la terapia inmunosupresora, el cáncer o cualquier tipo de enfermedad que pueda afectar a la inmunidad(4).
Diagnóstico
En las osteítis crónicas la presentación clínica puede ser muy variable. Los síntomas sistémicos suelen estar ausentes, aunque pueden cursar con fiebre. Los síntomas locales como dolor, inflamación, rubor, enrojecimiento de la zona afecta y presencia de fístulas no siempre están presentes y en ocasiones se presentan de forma intermitente e incluso años después del inicio de la infección(5).
En la analítica, lo más habitual, aunque no de manera constante, es encontrar elevados los leucocitos y parámetros como la velocidad de sedimentación globular (VSG) y la proteína C reactiva (PCR) en los casos agudos, siendo su alteración más variable en los procesos crónicos. Aunque no son totalmente específicas, sí son útiles para la monitorización del tratamiento(4,6,7). También podría aportarnos datos el aislamiento de gérmenes en los hemocultivos.
Dentro de las pruebas de imagen, la primera opción es la radiología simple. Es posible que en las fases iniciales no se encuentren cambios. Al nivel de las partes blandas se puede objetivar aumento de estas. En etapas posteriores podrían observarse áreas de secuestro óseo, destrucción ósea con diferentes patrones, adelgazamiento de las corticales, reacción perióstica y cambios líticos o escleróticos según la fase de la infección.
La ecografía aportaría datos sobre las partes blandas, detectando la presencia y la extensión de colecciones. La punción de estas y su análisis microbiológico conduciría a un primer diagnóstico de la infección. No obstante, proporciona pocos datos en relación con la afectación ósea(8).
La tomografía axial computarizada (TAC) es útil en la detección de colecciones y abscesos. También puede detectar trayectos fistulosos, secuestros óseos, destrucción de hueso cortical y trabecular, osificaciones y reacciones periósticas y, al nivel de los planos grasos y musculares, la presencia de edema. También permite la punción guiada de las posibles colecciones. Su principal inconveniente serían los artefactos que se producen en los casos con presencia de material metálico de osteosíntesis, lo cual disminuye su utilidad diagnóstica(9).
La resonancia magnética nuclear (RMN) aporta información sobre el grado de actividad y la extensión de la infección. Su utilidad, al igual que la de la TAC, se ve alterada por los artefactos metálicos en los casos en que el paciente es portador de material de osteosíntesis(10).
Los estudios de medicina nuclear o gammagrafía ósea detectan las zonas de inflamación y de osificación secundaria presentes en las osteítis crónicas, en los casos en los que el hueso conserva o tiene aumentada su actividad osteoblástica. Los isótopos utilizados son el metildifosfonato de tecnecio-99, el citrato de galio-77 y los leucocitos marcados con indio-111. Estos estudios tienen el inconveniente de ser muy sensibles pero poco específicos, ya que en otros procesos óseos también se pueden producir captaciones. El estudio con tecnecio-99 se realiza en 3 fases: la vascular temprana, la de partes blandas y la ósea tardía. Detecta áreas con mayor vascularización y actividad osteoblástica del hueso.
Si la gammagrafía con tecnecio-99 no es concluyente, están indicados los estudios con galio-77 o con leucocitos marcados con indio-111, que son más sensibles y específicos para la infección que el tecnecio-99(11,12).
La tomografía por emisión de positrones (PET-TAC) es un estudio con alta sensibilidad y especificidad para el diagnóstico de esta patología(13).
La fistulografía es otro método diagnóstico que permite aportar información para la estrategia quirúrgica, al permitir comprobar el trayecto existente entre el orificio de drenaje externo y el foco óseo de osteítis.
No obstante, la prueba de confirmación de la infección ósea crónica la constituye el examen microbiológico e histopatológico del hueso afecto. La presencia en el estudio histológico de abundantes neutrófilos polimorfonucleares es sugestiva de infección, siendo el aislamiento de los gérmenes en los cultivos la prueba de confirmación definitiva. El cultivo de las muestras obtenidas mediante frotis de las secreciones o de la fístula puede dar falsos positivos por contaminación de gérmenes de origen cutáneo.
Tratamiento
El tratamiento de la osteítis crónica debe tener un enfoque multidisciplinar y debe perseguir los siguientes objetivos(2,3):
- Resección del foco séptico óseo con oclusión de la posible cavidad resultante.
- Resección de las partes blandas afectas.
- Estabilización del hueso.
- Terapia antibiótica local y sistémica.
- Reconstrucción de las partes blandas afectas.
- Reconstrucción del defecto óseo.
Resección del foco óseo séptico, de partes blandas afectas y oclusión cavitaria
La resección del foco séptico óseo debe ir orientada a eliminar los trayectos fistulosos, el tejido de granulación reactivo presente y el hueso desvitalizado e infectado. A ello debe añadirse la extirpación de las partes blandas infectadas y las áreas de piel no viables.
Otro aspecto a tener en cuenta es la presencia o no de material de osteosíntesis. Siempre que sea posible, la cirugía debe ser radical y ha de perseguir la retirada de los implantes. Esto requerirá una ulterior reconstrucción del defecto óseo en casos de resección ósea amplia.
Se puede realizar una trinchera o ventana en el hueso, una resección segmentaria en bloque y, en caso de pandiafisitis, estaría indicada la resección mediante fresado intramedular.
Tras la adecuada resección focal, se ha de proceder a la oclusión de la cavidad, cuyo objetivo es eliminar espacios muertos que favorecen la persistencia y la recidiva de la infección. Existen diversas opciones, entre las que destacan:
- Puesta a plano de la zona séptica dejando la herida abierta para granulación y cierre por segunda intención. Estaría indicado en áreas de pequeño tamaño. Es un método clásico pero lento. En la actualidad, para acelerar el cierre se pueden asociar métodos como la terapia de presión negativa, la utilización de plasma rico en plaquetas (PRP) o factores plaquetarios, y también la aplicación de apósitos específicos que promueven la formación de tejido de granulación.
- Sistemas de irrigación-aspiración continua. Es un método poco utilizado en la actualidad que persigue que el espacio creado tras la resección ósea se vaya ocluyendo progresivamente con la formación de tejido de granulación y que estaría indicado en casos de osteítis diafisarias de huesos largos(14,15).
- Plastias musculares. El mecanismo de acción se basa en el relleno de la cavidad por un tejido vivo que aporta vascularización y antibioterapia(16,17).
Existen de 2 tipos, pediculadas o libres (estas precisan de una anastomosis microquirúrgica). Entre las pediculadas destacan las plastias de gemelo interno para la zona de la tibia proximal y entre las libres los colgajos fasciomiocutáneos obtenidos del muslo o bien del dorsal ancho.
Estarían indicadas en las osteítis crónicas con cavidades que no tienen riesgo de fractura. En el caso de las libres, además de ocluir la cavidad permiten realizar coberturas de pérdida cutánea de mayor entidad. - Injerto óseo. Se analizará en el apartado de reconstrucción del defecto óseo.
- Biomateriales portadores de antibiótico. El mecanismo de acción de todos ellos es ocluir las cavidades sépticas y aportar antibiótico localmente. El efecto antibiótico local es beneficioso en los focos de osteítis donde la vascularización es pobre y el antibiótico administrado por vía general puede ser deficitario para lograr niveles terapéuticos adecuados.
Existen diversos métodos, entre los que destacan los clásicos rosarios de cemento con gentamicina que no son biodegradables y requieren de su retirada tras el periodo de liberación antibiótica y sus análogos en forma de bolas de cemento impregnadas con diversos antibióticos. También pueden utilizarse diversos materiales biodegradables portadores de antibiótico que tienen como ventaja el no precisar de una nueva intervención para ser retirados. Otras alternativas son las esponjas de colágeno-gentamicina y las pastillas de sulfato cálcico impregnadas de antibiótico(18,19,20).
En casos de resección masiva o en bloque del hueso estaría indicada la colocación de espaciadores de cemento impregnados con antibiótico que permitirían a la vez ocluir el espacio séptico, mantener la longitud del hueso afecto y aportar antibiótico localmente, a la espera de realizar el tratamiento de reconstrucción ósea correspondiente.
Estabilización del hueso y reconstrucción de los defectos óseos
El método de actuación para la estabilización del hueso y su posterior reconstrucción deberá individualizarse en cada caso. Dependerá del grado de resección ósea realizado, que determinará la estabilidad, y de la presencia o no de material de osteosíntesis.
El material de osteosíntesis utilizado no se retira solo en condiciones excepcionales, siendo uno de los pilares del tratamiento su extracción.
Tras la retirada del material en casos de grandes defectos óseos que puedan provocar una refractura, una opción es la utilización de fijadores externos. El fijador externo proporciona en general una buena estabilidad y respeta a la vez las partes blandas. Existen diferentes modalidades, entre las que destacan los monolaterales, los circulares y los híbridos. La utilización de uno u otro dependerá de las circunstancias particulares de cada caso y de la experiencia y preferencia del cirujano. También está indicada la utilización del fijador en casos de resección masiva de hueso que van a precisar de un transporte óseo.
Para reconstruir las zonas de defectos óseos, las principales opciones son el injerto óseo y el transporte óseo.
Existe indicación de aportar injerto óseo en una cavidad osteítica en aquellos casos en que exista riesgo de fractura y en los casos en los que exista una pérdida ósea con discontinuidad segmentaria no mayor de 4 cm. Lo recomendable es utilizar hueso esponjoso autólogo, para lo cual se deben dar unas condiciones, como son una cobertura correcta de partes blandas libre de infección, una adecuada situación vascular, estabilidad del foco de osteítis y un contacto óptimo entre el hueso injertado y el hueso receptor.
En defectos óseos mayores de 4 cm en los cuales se ha realizado una resección segmentaria, estaría indicado el transporte óseo mediante fijador externo. Esta técnica es laboriosa y precisa de una amplia experiencia. Otra alternativa sería el injerto óseo microvascularizado, entre los que destacan los de cresta iliaca y los de peroné, que permiten solucionar a la vez defectos óseos y de partes blandas.
Reconstrucción de las partes blandas afectas
Es recomendable la reconstrucción de las partes blandas y de los defectos óseos de forma simultánea y coordinada.
Las opciones terapéuticas variarán en función del tamaño del defecto y de la presencia o no de exposición ósea. Las diferentes alternativas serían los injertos de piel libre, los colgajos pediculados y los colgajos miocutáneos libres microvascularizados. Los 2 últimos métodos, además de permitir una reconstrucción de las partes blandas, permiten la oclusión de las cavidades osteíticas(16,17).
Terapia antibiótica local y sistémica
Las diferentes opciones para aportar antibiótico localmente ya han sido expuestas anteriormente. La utilización de antibioterapia sistémica irá ligada siempre al tipo de microorganismo aislado en el foco de osteítis y a su antibiograma. La vía de administración y la duración dependerá de estos hallazgos y debe ser individualizada en cada caso.
Conclusiones
El tratamiento de las osteítis crónicas debe implicar la resección del tejido óseo y las partes blandas infectadas, su posterior reconstrucción y la utilización de la antibioterapia en función de los microorganismos aislados.
A continuación, se presentan 2 casos ilustrativos de osteítis crónicas.
Caso 1
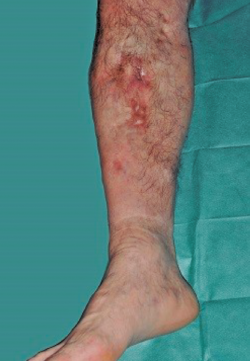
Se trata de un paciente varón de 57 años con antecedente de fractura abierta de tibia-peroné que evolucionó hacia la infección, requiriendo múltiples intervenciones hasta la consolidación de la fractura. Al cabo de 20 años se produce recidiva de la infección presentando fístula productiva al nivel de la cara medial del tercio proximal de la pierna (Figura 1).
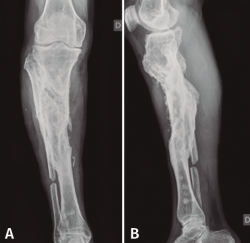
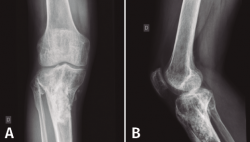
En el estudio radiológico (Figura 2) se objetiva fractura consolidada de la tibia con amplia desestructuración ósea.
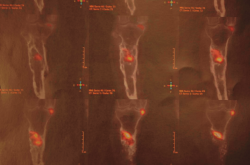
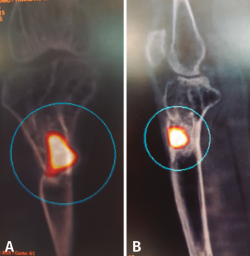
Tras estudio de tomografía computarizada de emisión monofotónica (SPECT-TAC) y gammagrafía con leucocitos marcados, se objetiva foco séptico al nivel del extremo proximal de la tibia (Figura 3).
Con el diagnóstico de osteítis crónica de la tibia se realiza desbridamiento óseo y de partes blandas, con posterior plastia de gemelo interno y antibioterapia específica.
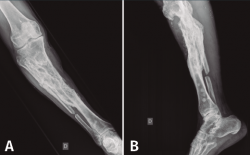
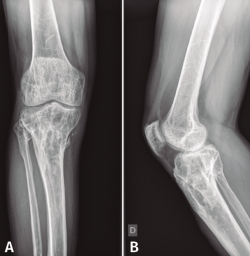
En el estudio radiológico posquirúrgico (Figura 4) se puede objetivar la resección ósea realizada.
La evolución posterior fue hacia la resolución del proceso infeccioso.
Caso 2
Se trata de un paciente varón de 52 años con antecedente de fractura de meseta tibial tratada mediante osteosíntesis y aporte de injerto de hidroxiapatita y posterior retirada del material de osteosíntesis tras la consolidación de la fractura. Al cabo de 6 años presenta fístula en la cara anterointerna del extremo proximal de la tibia.
En el estudio radiológico (Figura 5) se objetiva imagen cavitaria en el extremo proximal de la tibia con presencia de material granulado del injerto realizado.
Tras estudio de SPECT-TAC y gammagrafía con leucocitos marcados se objetiva foco séptico al nivel del extremo proximal de la tibia (Figura 6).
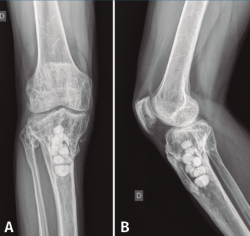
Con el diagnóstico de osteítis crónica de la tibia se realiza desbridamiento óseo de la cavidad y amplia resección ósea de cortical tibial medial, y relleno de la cavidad con bolas de cemento con antibiótico (Figura 7), con posterior tratamiento antibiótico.
Al cabo de 4 meses y tras la resolución del proceso séptico, se procede al relleno de la cavidad con injerto autólogo de cresta iliaca, cuya evolución fue hacia la incorporación de este (Figura 8).
Figuras
Figura 2. Radiografías de frente y de perfil de tibia-peroné donde se objetiva fractura consolidada con amplia desestructuración ósea.
Figura 3. Estudio de SPECT-TAC-gammagrafía con leucocitos marcados. Se objetiva captación compatible con proceso séptico en el extremo proximal de la tibia.
Figura 4. Radiografías de frente y de perfil de tibia-peroné donde se objetiva la resección ósea realizada.
Figura 5. Radiografías de frente y de perfil del extremo proximal de la tibia donde se objetiva la cavidad en la tibia con presencia de material granulado en su interior.
Figura 6. Estudio de SPECT-TAC-gammagrafía con leucocitos marcados. Se objetiva captación compatible con proceso séptico en el extremo proximal de la tibia.
Figura 7. Radiografías de frente y de perfil del extremo proximal de la tibia tras el desbridamiento de la cavidad y el relleno con bolas de cemento con antibiótico.
Información del artículo
Cita bibliográfica
Autores
José Simón Sánchez Díaz
Servicio de Traumatología y Cirugía Ortopédica. Clínica Mutua Universal. Barcelona
Elena Merino Peña
Servicio de Medicina Interna. Clínica Mutua Universal. Barcelona
Margarita Alonso Ortiz
Servicio de Medicina Interna. Clínica Mutua Universal. Barcelona
María del Mar Domínguez Pérez
Servicio de Rehabilitación. Clínica Mutua Universal. Barcelona
Bartolomé Ferreira Montenegro
Servicio de Cirugía Plástica y Reconstructiva. Clínica Mutua Universal. Barcelona
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de interés. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Waldvogel FA, Medoff G, Swartz MN. Osteomyelitis: a review of clinical features, therapeutic considerations and unusual aspects. N Engl J Med. 1970;282:198-206.
-
2Cierny G, Mader JT, Penninck JJ. A clinical stage system for adult osteomyelitis. Contemp Orthop. 1985;10:17-37.
-
3Hofmann G., Gonschorek O, Hofmann GO, BurenV. Stabilisierungsverfahren bei osteomyelitis. Osteosin Intern. 1997;5:226-2314.
-
4García del Pozo E, Collazos J, Cartón JA, Camporro D, Asensi V. Bacterial osteomyelitis: microbiological, clinical, therapeutic, and evolutive characteristics of 344 episodes. Rev Esp Quimioter. 2018;31(3):217-25.
-
5Lew DP, Waldvogel FA. Osteomyelitis. Lancet. 2004;364:369-79.
-
6Unkila-Kallio L, Kallio MJ, Eskola J, Peltola H. Serum C-reactive protein, erythrocyte sedimentation rate, and white blood cell count in acute hematogenous osteomyelitis of children. Pediatrics. 1994;93:59-62.
-
7Roine I, Faingezicht I, Arguedas A, Herrera JF, Rodríguez F. Serial serum C-reactive protein to monitor recovery from acute hematogenous osteomyelitis in children. Pediatr Infect Dis J. 1995;14:40-4.
-
8Hatzenbuehler J, Pulling TJ. Diagnosis and management of osteomyelitis. Am Fam Physician. 2011;84:1027-33.
-
9Tehranzadeh J, Wong E, Wang F, Sadighpour M. Imaging of osteomyelitis in the mature skeleton. Radiol Clin North Am. 2001;39:223-50.
-
10Hatzenbuehler J, Pulling TJ. Diagnosis and management of osteomyelitis. Am Fam Physician. 2011;84:1027-33.
-
11Abdullah ZS, Khan MU, Kodali SK, Javaid A. Pyomiositis mimicking osteomyelitis detected by SPECT/CT. Hell J Nucl Med. 2010;13:277-9.
-
12Chen WC, Tsai KD, Chen CH, Lin MS, Chen CM, Shih CM, Chen W. Role of gallium 67 scintigraphy in the evaluation of occult sepsis in the medical ICU. Intern Emerg Med. 2012;7:53-8.
-
13Strobel K, Stumpe D. PET/CT in musculoskeletal infection. Semin Musculoskelet Radiol. 2007;11:353-64.
-
14Fernández Sabaté A. Resección focal, relleno cavitario y cierre cutáneo en el tratamiento de las osteítis crónicas de los miembros. Med Clin. 1974;62:324-40.
-
15Evrard J. Irrigation continue d’ antibiotiques: enseignement d’une serie de 100 cas. Rev Chir Orthop. 1971;57:439-47.
-
16Vasconez LO, Bostwick J, McCrac J. Coverage of exponed bone by muscle transportation and skin grafting. Plast Reconstr Surg. 1974;53:526-30.
-
17Fitzgerald RH, Rutlle PE, Arnold PG, Kelly PJ, Irons JB. Local muscle flaps in the treatment of chronic osteomilelitis. J Bone Jt Surg. 1985;67-A:175-85.
-
18Klemm KW. Antibiotic bead chains. Clin Orthop. 1993;295:63-76.
-
19Stemberger A, Grimm H, Bader F, Ranh HD, Ascherl R. Local treatment of bone and soft tissue infections with collagen-gentamicin sponge. Eur J Surg. 1997;Suppl 578:17-26.
-
20McKee MD, Wild LM, Schemistch EH, Waddell JP. The use of an antibiotic-impregnated, osteoconductive, bioabsorbable bone substitute in the treatment of infected long bone defects: early results of a prospective trial. J Orthop Trauma. 2002 Oct;16(9):622-7.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Juntos, avanzamos y crecemos
- Seguimos adelante
- La infección asociada a la asistencia sanitaria en el entorno laboral
- Infección aguda en fractura tratada con osteosíntesis
- Artritis séptica de rodilla tras artroscopia de reconstrucción de ligamento cruzado anterior
- Pseudoartrosis séptica. Actualización en manejo y tratamiento
- Osteítis crónica
- Clínica Online: una herramienta útil para profesionales sanitarios y pacientes en medicina laboral
- Terapia de presión negativa con instilación en pacientes traumatológicos
- Propuesta de un protocolo de abordaje fisioterapéutico en pacientes en situación de baja laboral pendientes de intervención quirúrgica
- Análisis de la eficacia sobre el dolor y la capacidad funcional en el abordaje terapéutico de la epicondilopatía lateral crónica del codo con ondas de choque extracorpóreas radiales
- Plastia de rotación del ancóneo: una opción de rescate tras cirugía en epicondilitis crónica rebelde al tratamiento
- Accidente por electrización. ¡Estoy vivo!
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Traumatología Laboral está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.