Analgesia perioperatoria en cirugía artroscópica de muñeca y mano
Perioperative analgesia in arthroscopic surgery of the wrist and hand
Resumen:
Proporcionar una analgesia eficaz es esencial para la recuperación óptima del paciente después de una cirugía. Aunque es sabido que diferentes procedimientos quirúrgicos requieren enfoques específicos para el manejo del dolor, siguen sin existir estudios ni guías para el manejo específico del dolor en los procedimientos artroscópicos de muñeca.
Entre las estrategias terapéuticas de control del dolor postoperatorio destaca la analgesia multimodal, que puede aplicarse en todas las etapas perioperatorias.
Dentro del manejo preoperatorio, no hay estudios disponibles que demuestren si existe o no superioridad de la analgesia administrada antes de una artroscopia de muñeca. En el manejo intraoperatorio, la elección de anestesia general, bloqueos regionales periféricos, bombas de infusión continua, infiltraciones periarticulares, infiltraciones locales y/o la cirugía con el paciente despierto y sin isquemia (wide awake local anesthesia no tourniquet –WALANT–) depende de las características del paciente, de las patologías asociadas y de la localización y la duración estimada del procedimiento específico. La mayoría de los autores siguen recomendando el uso del bloqueo anestésico regional (supraclavicular, infraclavicular, axilar) para la analgesia en pacientes sometidos a artroscopia de muñeca.
Los analgésicos orales son los pilares del control analgésico una vez que el paciente sale del hospital. Después de este tipo de cirugías, generalmente se utiliza una combinación de medicamentos orales entre los que se incluyen el paracetamol, antiinflamatorios no esteroideos (AINE) y combinaciones de ambos con distintos opioides menores. De ellos se conoce la posología, pero no cuánto tiempo se deben administrar, ni cuál es la mejor y más efectiva combinación.
A corto plazo, se deberían realizar estudios y elaborar guías específicas para el manejo del dolor en los procedimientos artroscópicos de muñeca y mano, con el fin mejorar la recuperación de los pacientes y evitar las negativas consecuencias de un mal control posquirúrgico del dolor.
Abstract:
Effective analgesia is essential for optimum patient recovery after surgery. Although different surgical procedures require specific pain management strategies, studies or guides for the specific management of pain in arthroscopic procedures of the wrist remain lacking.
Among the different postoperative pain management strategies, mention must be made of multimodal analgesia, which can be applied in all the perioperative stages.
In relation to preoperative management, no studies to date have confirmed or discarded the superiority of analgesia administered before wrist arthroscopy. In intraoperative management, the choice of general anaesthesia, peripheral regional blocks, continuous infusion pumps, periarticular infiltrations, local infiltrations and/or wide awake local anaesthesia with no tourniquet (WALANT) depends on the patient characteristics, the associated disease conditions, and the location and estimated duration of the specific procedure involved. Most authors continue to recommend regional anaesthetic block (supraclavicular, infraclavicular, axillary) for analgesia in patients subjected to wrist arthroscopy.
Oral analgesics are the cornerstone of pain control once the patient leaves the hospital. Following surgeries of this kind, use is generally made of a combination of oral drugs including paracetamol, non-steroidal anti-inflammatory drugs (NSAIDs) and combinations of both with different mild opioids. The corresponding dosing specifications are known, but it is not clear for how long these medications are to be administered, or which is the best and most effective combination.
Studies are needed and specific guides should be developed for pain management in arthroscopic procedures of the wrist and hand, in order to improve patient recovery and avoid the negative consequences of poor postoperative pain control.
Introducción
La exploración artroscópica de la muñeca se lleva realizando décadas, pero el desarrollo de las técnicas quirúrgicas artroscópicas de muñeca es relativamente reciente. Son varios los factores que han favorecido este progreso, entre los que destacan la mejora de las técnicas anestésicas y los nuevos abordajes analgésicos. A pesar de ello, el adecuado control del dolor postoperatorio sigue constituyendo un problema para los pacientes y un reto para los cirujanos de mano y, hoy por hoy, siguen sin existir estudios ni guías para el manejo específico del dolor en estos procedimientos artroscópicos.
Al no existir publicaciones relevantes sobre el manejo perioperatorio del dolor en cirugía artroscópica de mano y muñeca, el objetivo de este artículo es realizar una revisión de la bibliografía en lo concerniente a la analgesia perioperatoria en cirugía del miembro superior, tratando de adaptar las conclusiones obtenidas al entorno de dichos procedimientos.
Dolor perioperatorio en cirugía artroscópica de muñeca y mano
El dolor postoperatorio continúa siendo una de las principales quejas de los pacientes tras una cirugía (tanto las ambulatorias como las que requieren ingreso). Se sabe que aproximadamente un tercio de los pacientes refieren dolor moderado o intenso posquirúrgico(1,2) y que este está relacionado con el aumento de visitas a los servicios de urgencias y a las consultas(3), e incluso con el desarrollo de dolor crónico(4). En pacientes ancianos, además, se ha asociado con deterioro cognitivo, incremento del riesgo de demencia, pérdida de memoria y pérdida de actividad funcional(2). Teniendo en cuenta estas potenciales consecuencias en la calidad de vida de los pacientes, es evidente que dentro de la estrategia quirúrgica debe contemplarse el correcto tratamiento del dolor perioperatorio.
La mayoría, si no todos, los procedimientos artroscópicos de mano y muñeca se pueden realizar de manera ambulatoria o con una estancia hospitalaria de unas pocas horas. Por mucho que se trate de una cirugía mínimamente invasiva, sin un apropiado control del dolor esto no sería posible. A pesar de que en los últimos años ha habido grandes avances en el desarrollo de recomendaciones para el manejo del dolor específico de cada procedimiento quirúrgico (Procedure Specific Postoperative Pain Management –PROSPECT–), gracias a iniciativas como la de la European Society of Regional Anesthesia and Pain Therapy (ESRA), el adecuado control del dolor postoperatorio sigue constituyendo un problema para los pacientes y cirujanos, y siguen sin existir guías específicas para el manejo del dolor en estos procedimientos, a pesar de que se sabe que, controlándolo, los pacientes evolucionan más confortable y eficientemente durante el proceso de rehabilitación y mejora su satisfacción y los resultados quirúrgicos(5).
Existen varias estrategias terapéuticas para ofrecer a los pacientes un buen control del dolor. Entre ellas destaca, por su demostrada eficiencia, la conocida como analgesia multimodal, que se consigue combinando diferentes analgésicos que actúan a través de diferentes mecanismos (por ejemplo, opioides, antiinflamatorios no esteroideos –AINE– y anestésicos locales) con el fin de obtener una analgesia aditiva o sinérgica, con dosis más bajas de analgésicos y con menos efectos secundarios. El uso de la analgesia multimodal no solo ha demostrado disminuir la intensidad del dolor, sino también la cantidad necesaria de analgésicos tras una cirugía(6).
El manejo del dolor comienza en el momento preoperatorio con una adecuada información al paciente, resolviendo sus dudas y explicándole el proceso tanto quirúrgico como posquirúrgico. Una estrategia analgésica postoperatoria eficaz empieza con la anestesia intraoperatoria, puesto que se ha demostrado que puede afectar al nivel y la percepción del dolor después de la cirugía. La elección de anestesia general, bloqueos regionales periféricos, bombas de infusión continua, infiltraciones periarticulares, infiltraciones locales y/o la cirugía con el paciente despierto (wide-awake local anesthesia no tourniquet –WALANT–) depende de las características del paciente, de las patologías asociadas y de la localización y la duración estimada del procedimiento específico. La analgesia postoperatoria comienza en la sala de reanimación o unidad de cuidados postanestesia, e incluye la crioterapia, medicamentos inyectables y orales, parches transdérmicos y bloqueos regionales selectivos. La combinación de estos métodos puede condicionar tanto la duración de la estancia hospitalaria como el nivel de control del dolor en las primeras horas tras la desaparición del efecto de la sedación. Sin embargo, quizás el componente más desafiante de la estrategia analgésica sea la selección de la pauta de medicación domiciliaria adecuada, puesto que la excesiva medicación puede provocar efectos secundarios importantes, que afecten significativamente la función de los pacientes, mientras que el control inadecuado del dolor aumenta la morbilidad y el sufrimiento del paciente.
Manejo preoperatorio
Existe controversia sobre el momento adecuado del comienzo de la terapia analgésica.
Para poder entender esta controversia, es importante entender y discernir entre los conceptos de analgesia preventiva (anticipatoria), que estipula que es más importante empezar el tratamiento nociceptivo antes de la incisión quirúrgica, y la analgesia precautoria, que abarca todos los esfuerzos perioperatorios para disminuir el dolor y el consumo de opioides(7). Si bien importantes estudios de revisión, como el de Moiniche et al.(8), demostraron que no existía una superioridad de la analgesia administrada antes de la cirugía, otros estudios han verificado que el uso pre- y postoperatorio de AINE, incluyendo ketorolaco, ibuprofeno y celecoxib, reduce significativamente el dolor postoperatorio(9,10,11). Por otro lado, no se ha demostrado la eficacia del paracetamol administrado antes de la incisión, aunque, erróneamente, una reciente revisión de la bibliografía de Neumeister et al.(12) le achacase la reducción del consumo postoperatorio de morfina en un 20%, si se administraba 24 horas antes de la cirugía. Con respecto a la cirugía artroscópica de muñeca y mano en particular, no hay estudios disponibles que demuestren una u otra evidencia.
Manejo intraoperatorio
Los principios básicos que rigen el plan anestésico intraoperatorio deberían incluir técnicas multimodales, la administración óptima de opioides y la anestesia más útil en todos los sentidos para el paciente. Este plan anestésico incluye técnicas inhalatorias, intravenosas o regionales (periféricas o neuroaxiales). El anestesista debe proporcionar un correcto cuidado intraoperatorio y conseguir que esa combinación de técnicas sea la mejor para el paciente a lo largo de todo el proceso perioperatorio(7). La elección de analgesia y anestesia durante el procedimiento quirúrgico no solo dicta la duración de la estancia del paciente en el hospital tras la cirugía, sino que puede tener un gran efecto sobre el nivel de dolor postoperatorio y su control. La elección de anestesia general, bloqueos regionales periféricos, bombas de infusión continua, infiltraciones periarticulares, infiltraciones locales y/o WALANT depende de las características del paciente, de las patologías asociadas y de la localización y la duración estimada del procedimiento específico(1).
Anestesia general
Existe evidencia de que en otras articulaciones del miembro superior(13,14), a diferencia de la anestesia general, la anestesia regional suele proporcionar tiempos de recuperación más cortos y altas hospitalarias más rápidas tras la cirugía.
Con respecto a la cirugía de la mano en concreto, Chan et al.(15) encontraron que la anestesia regional se asociaba con una recuperación del paciente más favorable que la anestesia general, que requería menos cuidados de enfermería en la sala de reanimación y que se conseguía un alta hospitalaria más temprana. Estos hallazgos fueron confirmados, de nuevo, unos años más tarde por McCartney et al.(16). Sin embargo, Ketonis et al.(1) no identificaron diferencias respecto a la anestesia general en el nivel de dolor entre el primer día postoperatorio y hasta 14 días después de la cirugía.
Bloqueos regionales periféricos
El uso de la anestesia regional puede ser una de las herramientas más poderosas en el arsenal de los anestesiólogos contra el dolor postoperatorio intenso. Se ha demostrado que mejora la analgesia postoperatoria y la satisfacción del paciente(17). Los bloqueos del plexo de inyección única son actualmente la modalidad más utilizada para anestesia regional en la cirugía de mano y muñeca. Consisten en inyectar un anestésico local en una zona determinada del plexo braquial proporcionando un efecto analgésico de 12 a 24 horas de duración. Sus beneficios son numerosos e incluyen mejoras en los resultados clínicos, económicos y humanos. Se han asociado con una mejoría en el control del dolor postoperatorio y con la reducción del uso de opioides en muchos procedimientos quirúrgicos(18) (aunque en nuestro medio no es un problema preocupante por su limitado uso). Al disminuir la necesidad de opioides, puede disminuir el riesgo de náuseas y vómitos postoperatorios, la alteración del estado mental y el prurito, facilitando de este modo la reducción de la utilización de los recursos hospitalarios y el alta del centro quirúrgico(19), además de mejorar la recuperación y la satisfacción del paciente(20). Para las cirugías artroscópicas de mano y muñeca, se pueden utilizar los bloqueos supraclaviculares, infraclaviculares o axilares.
Bloqueo supraclavicular del plexo braquial
El bloqueo supraclavicular del plexo braquial se realiza al nivel de las divisiones anterior y posterior de los troncos del plexo braquial. Este bloqueo proporciona una anestesia completa y fiable de la extremidad superior por debajo del tercio medio del brazo. Se puede utilizar para operaciones del húmero distal, el codo, el antebrazo, la muñeca o la mano. La dosis típica de anestésico local es de 20 a 25 mL de ropivacaína o bupivacaína al 0,5%. A diferencia de los bloqueos interescalénicos, más utilizados e indicados para la cirugía de hombro, el bloqueo supraclavicular se asocia con una menor incidencia de bloqueo del nervio frénico (C3-C5) y paresia hemidiafragmática ipsilateral secundaria. Sin embargo, se debe tener cuidado al considerar este tipo de bloqueo en pacientes con enfermedad pulmonar preexistente, pues pueden ser incapaces de tolerar cualquier disminución de la función pulmonar(21).
Bloqueo infraclavicular del plexo braquial
El bloqueo infraclavicular del plexo braquial se dirige al plexo braquial al nivel de los cordones, antes de la salida del nervio axilar y musculocutáneo, proporcionando anestesia a la extremidad superior por debajo del tercio medio del brazo. Se trata de un bloqueo muy adecuado para procedimientos que involucran el brazo, el codo, el antebrazo, la muñeca y la mano. La dosis habitualmente utilizada de anestésico local es de 20 a 30 mL de ropivacaína al 0,5%. En comparación con los bloqueos interescalénico y supraclavicular, el bloqueo infraclavicular se asocia con una incidencia muy baja de bloqueo del nervio frénico (C3-C5) y paresia hemidiafragmática ipsilateral secundaria. No obstante, una posible complicación es el neumotórax si la aguja se introduce demasiado en profundidad(21).
Bloqueo axilar del plexo braquial
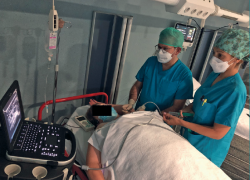
El bloqueo axilar (Figura 1) se dirige a las ramas terminales del plexo braquial. Se puede utilizar para operaciones del codo, el antebrazo, la muñeca y la mano, pero típicamente es necesario asociar un bloqueo del nervio musculocutáneo para proporcionar analgesia de todo el antebrazo. La dosis típica de anestésico local es de 20 a 30 mL de ropivacaína al 0,5%. Con el bloqueo axilar no se ha descrito parálisis del nervio frénico, lo que hace que esta técnica suponga una excelente opción para pacientes con antecedentes de enfermedad pulmonar severa. Además, el bloqueo axilar es una opción razonable en pacientes anticoagulados, porque cualquier hematoma inadvertido puede ser rápida y ampliamente comprimido(21).
Los riesgos potenciales de los bloqueos nerviosos periféricos, independientemente de la técnica o la ubicación del bloqueo, incluyen punción vascular y sangrado, lesión de los nervios y toxicidad sistémica por anestésicos locales. Las complicaciones neurológicas son de particular interés porque la duración de los síntomas puede alcanzar semanas o meses después de la cirugía. Los pacientes suelen describirlas como hormigueo, dolor al presionar la zona de punción o pinchazos(22,23). Los signos y síntomas de la toxicidad sistémica por anestésicos locales dependen de la dosis y van desde sabor metálico, tinnitus y entumecimiento perioral hasta convulsiones, paro cardiaco y muerte(24).
Dados los grandes beneficios demostrados por los bloqueos nerviosos periféricos en la práctica, su utilización se ha expandido durante las últimas décadas y, con ello, también los avances técnicos, entre los que se incluye el uso del guiado ecográfico, que ha mejorado significativamente la seguridad, disminuyendo la incidencia de punciones vasculares(25), y ha permitido la colocación y la aplicación más precisa de los bloqueos con menores volúmenes de anestésico(1). Otro avance ha sido el paso del uso de inyecciones únicas de anestésico local a la infusión continua de anestésico administrado mediante un catéter perineural.
La principal limitación de los bloqueos de una única inyección es la corta duración de acción de la mayoría de los anestésicos locales. Este tipo de bloqueos son, por lo tanto, muy adecuados para procedimientos quirúrgicos en los que no se espera que el dolor postoperatorio exceda las 12-24 horas de duración porque, de lo contrario, los pacientes corren el riesgo de sufrir dolor por un efecto rebote significativo tras el alta. La administración de mayores volúmenes o concentraciones más altas de anestésicos es posible y puede aumentar la duración del bloqueo, pero también el riesgo de bloqueo motor y de toxicidad sistémica del anestésico local(18,26). A diferencia de los de inyección única, la administración de anestésicos locales mediante infusión continua permite una duración de la analgesia significativamente más prolongada, con menos dolor y necesidad de consumo de opioides tras la cirugía(27). Su disponibilidad ha permitido que pacientes seleccionados sean dados de alta con una bomba de infusión ambulatoria en lugar de permanecer en el hospital o recibir otros analgésicos orales en casa. Es importante, para su correcto uso y eficacia, la selección adecuada del paciente, el seguimiento y la educación sobre el manejo y la extracción de la bomba. Dentro de los pacientes no candidatos se incluyen aquellos con insuficiencia renal y hepática conocida, enfermedad cardiaca y/o pulmonar(28), alteraciones del estado mental o problemas psicosociales(29), imposibilidad de ser contactado tras el alta o para acceder a un centro médico en caso de emergencia(26), y aquellos que no quieren aceptar la responsabilidad de la gestión de la bomba(28). Antes del alta, se debe educar a los pacientes sobre el uso, el funcionamiento y el cuidado del catéter y el apósito(18,29). Otra consideración importante a tener en cuenta es que los costes (tanto económicos como en tiempo) asociados a este tipo de bloqueos son significativos y deben ser valorados por los médicos y por los hospitales que implementan esta técnica.
La incidencia de complicaciones de los bloqueos de infusión continua depende en gran medida de la técnica de inserción y de la zona del bloqueo(18). Dentro de las complicaciones menores se incluyen el desplazamiento del catéter(30) (hasta el 25% de los casos), la obstrucción y la fuga de líquido en el área del catéter(31). Aunque se han reportado altas tasas de colonización bacteriana del catéter, la infección clínicamente relevante es rara(31). Los factores de riesgo de colonización de un catéter incluyen la duración del catéter mayor a 48 horas, la diabetes y la administración de antibióticos durante el mes anterior a la cirugía(32).
Es cierto, por tanto, que aunque los catéteres de infusión continua eliminan la limitación principal de los bloqueos nerviosos de una única inyección, han introducido un nuevo conjunto de dificultades que los hacen de difícil aplicación rutinaria.
Se precisan, para el futuro, nuevas modalidades de catéteres de infusión continua que minimicen los riesgos de complicaciones y los costes, para que se extienda su uso.
Infiltraciones locales, periarticulares y WALANT
Animados por los estudios de Rolf et al.(33,34), que demostraron el uso exitoso de la inyección de anestésico local en los portales para la realización de artroscopias de rodilla y tobillo, los cirujanos de mano transfirieron la experiencia a la artroscopia de muñeca y desarrollaron la técnica, abriendo un nuevo horizonte que, con el tiempo, se ha ido expandiendo. A diferencia de la cirugía de rodilla, la ventaja en el caso de la artroscopia de muñeca es que la sedación no es necesaria para conseguir buenos resultados, ya que es posible que el espasmo de la musculatura voluntaria no sea tan crítico(35). También a través de la experiencia obtenida con la artroscopia de rodilla, Karaoglu et al.(36) hallaron que el sangrado en la artroscopia provenía principalmente de la zona de incisión en los portales. Una vez que se ha constatado también que es seguro inyectar adrenalina, potente vasoconstrictor, en la mano y los dedos(37,38), con la inyección de anestesia local mezclada con adrenalina en el portal se puede obtener una visión clara sin provocar cambios hemodinámicos, ni isquemia o necrosis en los dedos.
Dentro de las ventajas de la técnica WALANT, al igual que con los bloqueos regionales periféricos, está que durante la artroscopia puede establecerse una interacción entre el paciente y el cirujano que es beneficiosa para ambos, pues, para algunos pacientes, la capacidad de visualizar la reparación de las lesiones refuerza su confianza en el cirujano y les anima a cumplir con la rehabilitación postoperatoria(39). Además, aunque la aplicación de la técnica WALANT no ha eliminado los riesgos de iatrogenia sobre los tendones por completo, sí permite la evaluación inmediata de los movimientos de los dedos intraoperatoriamente y tratar las complicaciones con inmediatez.
La clave para el éxito de esta técnica consiste en aplicar de forma eficaz la anestesia local en la localización del portal. Esto exige un gran conocimiento de la anatomía de superficie y una gran maestría para crear los portales. Para evitar el movimiento secundario de la piel, algunos autores recomiendan preparar, colocar y asegurar la extremidad con la tracción necesaria antes de infiltrar el anestésico local. A diferencia de los procedimientos quirúrgicos abiertos con WALANT, donde generalmente se recomienda un volumen generoso de anestésico local y un tiempo de espera considerable, para la artroscopia solo se requiere un pequeño volumen de anestésico local y un mínimo tiempo de espera para que la anestesia en el portal sea efectiva(39,40). El tipo de anestésico local y las dosis utilizadas varían entre los distintos autores(35,39,41,42). Hagert y Lalonde(43) utilizan 20 mL de una solución de lidocaína al 1% (10 mg/mL) con adrenalina (5 mg/mL) y 2 mL de bicarbonato de sodio (50 mg/mL) para la infiltración del dorso de la muñeca, añadiendo 5 mL adicionales de lidocaína al 1% con adrenalina dentro de la articulación radiocarpiana. Estos últimos autores recomiendan la administración de la anestesia al menos 30 minutos antes de la cirugía para dar tiempo a adquirir el nivel anestésico deseable. Sin embargo, los autores que utilizan como anestésico local la lidocaína a mayor concentración (2%), que tiene un inicio de acción mucho más rápido, comienzan la operación casi inmediatamente tras su administración(35). Asimismo, hay autores que piensan que la infiltración intraarticular de anestésico no es necesaria en la mayoría de las ocasiones, a no ser que se prevea un procedimiento terapéutico intraarticular considerable(35). Si es así, la inyección adicional de 4 mL de anestésico local con adrenalina dentro de la articulación facilita una anestesia adecuada(39). Esta mezcla también proporciona una hemostasia local eficaz en la cápsula articular y la membrana sinovial y, por lo tanto, evita el uso rutinario de un torniquete(35). Si fuera necesario, la anestesia local en los portales se puede combinar con las técnicas de infiltración WALANT para la cirugía abierta.
Los riesgos potenciales de la anestesia inyectada en los portales incluyen los efectos sistémicos del anestésico local si se filtra a la circulación general, el efecto vasoconstrictor de la adrenalina y el riesgo teórico de daño permanente del cartílago cuando se inyecta el anestésico local en la articulación. El temor de causar daño permanente al cartílago proviene de estudios sobre la viabilidad de los condrocitos en contacto con estos medicamentos a base de amida, como lidocaína, bupivacaína o levobupivacaína in vitro y en animales de laboratorio(44,45,46,47). Sin embargo, no se ha demostrado en estudios clínicos una causalidad directa entre la infusión de anestésico local y la condrólisis(35). Tampoco existe, hasta el momento, ningún estudio sobre el efecto de los anestésicos locales sobre el cartílago articular en la artroscopia de muñeca.
Son contraindicaciones absolutas para esta técnica la hipersensibilidad conocida a alguno de los anestésicos locales utilizados y la adrenalina. La presencia de enfermedad cardiaca se ha mencionado en la literatura como una contraindicación relativa porque este grupo de pacientes puede ser especialmente sensible a la adrenalina(48). No se considera una técnica adecuada para procedimientos que requieren mucho trabajo sobre el hueso. Y, por último, no son candidatos a esta técnica los pacientes jóvenes e inmaduros, pacientes con ansiedad severa, discapacidad intelectual, enfermedad psiquiátrica no controlada o un umbral de dolor bajo(35).
La naturaleza mínimamente invasiva de la artroscopia la convierte en especialmente adecuada para la técnica WALANT; sin embargo, a diferencia de los bloqueos, no ofrece un buen control analgésico tras la cirugía. Estudios como los de Hansen y Jakobsen(49) han demostrado que la inyección intraarticular de 5 mL de bupivacaína al 0,5% tras la artroscopia de muñeca reduce el dolor y la necesidad de analgésicos solo durante las 2 primeras horas. Por lo que se recomienda el bloqueo anestésico para la artroscopia de muñeca(41).
Manejo postoperatorio
Sala de reanimación
El manejo efectivo del dolor en la sala de reanimación puede tener un gran impacto en la satisfacción y el bienestar de los pacientes, el tiempo de ingreso y la evolución postoperatoria una vez que regresan a casa tras la cirugía. La morfina y el fentanilo son los fármacos que más frecuentemente se administran a los pacientes ambulatorios durante la primera fase de recuperación. La recomendación del fentanilo se debe a que tiene un tiempo de acción muy rápido y, por lo tanto, permite un control más rápido del dolor, disminuyendo potencialmente la dosis total de opioides usados para tal fin y los potenciales efectos secundarios relacionados(1). En un ensayo prospectivo aleatorizado, Claxton et al.(50) llegaron a la conclusión de que combinando la morfina con el fentanilo se reducen los efectos secundarios, se puede facilitar el alta hospitalaria y se producen menos complicaciones después del alta, al reducirse consecuentemente la dosis de morfina necesaria para controlar el dolor.
Analgesia domiciliaria
La extensión de la estrategia de la analgesia multimodal al periodo postoperatorio ha demostrado un gran beneficio en el control del dolor(7). Los analgésicos orales son los pilares del control analgésico una vez que el paciente sale del hospital. Los medicamentos prescritos deben cumplir los objetivos de permitir al paciente realizar las actividades normales de su vida diaria, producir mínimos efectos secundarios, no interferir con el proceso de curación y cicatrización, y ser fáciles de manejar por el paciente(1). En el contexto de una lesión, las prostaglandinas se encuentran como mediadores inflamatorios que sensibilizan los nociceptores en la vía del dolor tanto del sistema nervioso central como del periférico. La modulación de la vía inflamatoria es, por lo tanto, un objetivo clave para el control del dolor postoperatorio(12). Por ello, después de una cirugía artroscópica de muñeca ambulatoria generalmente se utiliza una combinación de medicamentos orales que reducen la inflamación y la producción de prostaglandinas, incluyendo el paracetamol, AINE y combinaciones de ambos con distintos opioides menores. De estos medicamentos se conoce la posología, pero aún no se ha encontrado evidencia concluyente sobre cuánto tiempo se deben administrar(7). Del mismo modo, tampoco existe evidencia de que ningún fármaco tenga efectividad específica para estos procedimientos.
Paracetamol
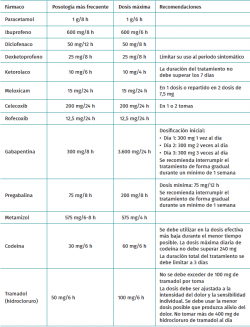
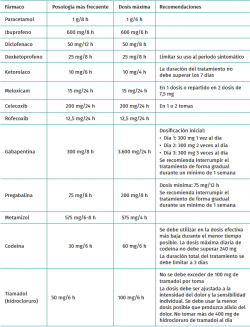
El paracetamol es uno de los analgésicos más utilizados en todo el mundo. Se sabe que la analgesia con paracetamol tiene un techo no muy alto, pero puede ser adecuada para el tratamiento del dolor leve a moderado. Se trata de un medicamento eficaz, seguro, barato y con un perfil de efectos adversos favorable(51). Sin embargo, su mecanismo de acción es poco conocido. Existe alguna evidencia de que tiene un efecto antinociceptivo central y también puede prevenir la producción de prostaglandinas a nivel celular. A diferencia de los AINE, no irrita la mucosa gástrica, no afecta la función plaquetaria ni provoca insuficiencia renal, por lo que se trata de un medicamento muy versátil(1). La dosis más utilizada es de 1 g cada 8 horas, si bien se puede alcanzar la dosis máxima de 1 g cada 6 horas, si se precisa (Tabla 1).
Antiinflamatorios no esteroideos (ibuprofeno, diclofenaco, dexketoprofeno, ketorolaco, meloxicam)
Los AINE forman parte de la mayoría de los regímenes de dolor de cirugía ambulatoria, incluidas las artroscopias de muñeca. Sus propiedades antiinflamatorias no solo proporcionan alivio del dolor, sino que también pueden ayudar a reducir el edema local y minimizar el uso de fármacos más potentes. Se considera que, en situaciones en las que no existen contraindicaciones, los AINE son el fármaco de elección tras la mayoría de las cirugías ambulatorias(52). Aunque hay informes de que ejercen alguna acción central(53), el mecanismo de acción aceptado en la actualidad sigue siendo la atenuación de la síntesis de prostaglandinas mediante la inhibición de las enzimas ciclooxigenasa(54) (COX). Una de las principales preocupaciones con el uso de los AINE sigue siendo su toxicidad gastrointestinal, lo que llevó al descubrimiento de las 2 isoenzimas COX y los fármacos selectivos para COX-2 que la Organización Mundial de la Salud ha clasificado como una nueva subclase de AINE: los coxib.
Estos tienen una eficacia analgésica equipotente en relación con los AINE tradicionales(55) y, a pesar de la continua controversia sobre la seguridad y la preocupación por un mayor riesgo de infarto de miocardio, todos los estudios indican que no parece haber diferencias claras en los riesgos cardiovasculares de los coxib actualmente disponibles y los AINE no selectivos cuando se utilizan con las dosis recomendadas(1,56). Otra de las preocupaciones con el uso de los AINE es el riesgo teórico asociado de provocar problemas de consolidación ósea, pero no existe evidencia suficientemente fuerte de este efecto como para excluir su uso en los procedimientos ortopédicos(57). Las dosis más utilizadas de los AINE utilizados con más frecuencia en nuestro medio, sus dosis máximas y algunas recomendaciones vienen detalladas en la Tabla 1.
Gabapentinoides
Los gabapentinoides, como la gabapentina y la pregabalina, actúan bloqueando los canales de calcio dependientes del voltaje y modulando la liberación de neurotransmisores excitadores(9), reduciendo la hipersensibilidad en las neuronas del asta dorsal de la médula espinal(57). Se asocian con una reducción del dolor postoperatorio y un menor riesgo de progresión al dolor crónico, al mitigar la sensibilización central y periférica(12). Ambos medicamentos han demostrado eficacia tanto administrados postoperatoriamente como cuando se dosifican antes de la operación, si bien no hay consenso sobre la dosis perioperatoria recomendada. Hay estudios que recomiendan comenzar el tratamiento 2 semanas antes de la cirugía(58), otros recomiendan tan solo una dosis alta en bolo 1 o 2 horas antes de la cirugía y, por último, los hay que limitan su uso al postoperatorio(17). Las dosis más utilizadas de la gabapentina y la pregabalina, las recomendaciones y las dosis máximas vienen detalladas en la Tabla 1.
Metamizol
El metamizol es un analgésico no opioide con componentes antipiréticos, antiespasmódicos y antiinflamatorios(59). Su zona y mecanismo de acción analgésica no están claramente definidos. Parece que están implicadas zonas de acción centrales y periféricas, de forma combinada(60). El metamizol proporciona buenos niveles de analgesia (se considera que es más potente que el paracetamol) con baja incidencia de efectos secundarios y su biodisponibilidad prácticamente completa hace que la vía de administración oral sea favorable en la mayoría de los casos(61). La dosis más utilizada es de 575 mg cada 6-8 horas. Se puede alcanzar la dosis máxima de 575 mg cada 4 horas, si se precisa (Tabla 1).
Opioides menores (codeína y tramadol)
La codeína y el tramadol son los opioides menores orales de uso más común.
La codeína en sí misma carece de actividad analgésica. Su eficacia se basa en la transformación metabólica de la codeína a morfina (2 al 10% de la dosis administrada). Teniendo en cuenta que la enzima responsable para esta conversión a morfina (CYP) falta en aproximadamente el 10% de los caucásicos(62), en nuestro medio puede suponer un gran inconveniente para su eficacia.
La dosis recomendada de codeína es de 30 mg cada 6 horas. Se debe utilizar en la dosis efectiva más baja durante el menor tiempo posible. La dosis máxima diaria no debe superar 240 mg y la duración total del tratamiento se debe limitar a 3 días (Tabla 1).
El tramadol tiene efecto como agonista opioide y, de forma combinada, como inhibidor de la recaptación de la serotonina y la noradrenalina(63). Su forma de administración oral generalmente es en forma de hidrocloruro y su perfil de efectos adversos es diferente al de otros opioides. El riesgo de depresión respiratoria es significativamente menor a dosis equianalgésicas(64). Tiene efectos limitados sobre la función motora gastrointestinal y causa menos estreñimiento que la morfina(65,66). Su principal inconveniente es una alta incidencia de náuseas y vómitos, que conlleva una mayor insatisfacción por parte del paciente(66). La dosis recomendada de hidrocloruro de tramadol es de 50 a 100 mg cada 4-6 horas. No se deben exceder los 100 mg de tramadol por toma. Normalmente se debe usar la menor dosis posible que produzca alivio del dolor. No se debe tomar más de 400 mg de hidrocloruro de tramadol al día (Tabla 1).
Son muy comúnmente utilizadas las fórmulas medicamentosas que combinan tramadol y paracetamol a distintas dosis. La presentación farmacológica más frecuentemente utilizada es la de 37,5 mg/325 mg, respectivamente, cuya dosis habitual es de 2 comprimidos cada 8 horas, y la dosis máxima de 2 comprimidos cada 6 horas.
Un estudio de 2007 que comparaba los efectos analgésicos del tramadol, el metamizol y el paracetamol en pacientes sometidos a cirugía ambulatoria de la mano mostró que ninguno de los 3 de forma aislada proporcionó analgesia eficaz en todos los pacientes(66). El porcentaje de pacientes que requirieron rescate con otro opioide en casa fue del 42% con el paracetamol, del 31% con el metamizol y del 23% con el tramadol. Sin embargo, el tramadol se asoció con una mayor frecuencia y gravedad de efectos adversos como náuseas y mareos y, como consecuencia, una mayor insatisfacción de los pacientes.
Teniendo en cuenta que no se ha demostrado superioridad de ninguna asociación de medicamentos sobre otra, la educación y la información del paciente sobre qué esperar, la forma de controlar el dolor y cómo utilizar los medicamentos recetados sigue siendo primordial(1) Un paciente involucrado y bien informado del plan de tratamiento, las opciones, los objetivos y las expectativas de dolor tras la cirugía presentará mayor grado de satisfacción que el que no lo está.
Medidas físicas
Además de las medidas farmacológicas, se deben considerar las medidas físicas en el manejo postoperatorio del dolor. Estas incluyen la crioterapia, la estimulación nerviosa eléctrica transcutánea (TENS), la acupuntura, los masajes y el calor local. Todas ellas son seguras y prácticamente no conllevan ningún riesgo para el paciente.
La TENS consiste en la aplicación de corriente eléctrica a través de electrodos de superficie, pegados sobre la piel, con el objetivo de eliminar el dolor. La TENS crea una hiperestimulación de las fibras sensitivas que bloquea la transmisión sináptica de las fibras a nivel medular. Se cree que activa vías inhibitorias del dolor descendente, reduciendo la respuesta al dolor. Generalmente, los electrodos se colocan directamente sobre la piel de la zona intervenida, pero algunos estudios han informado de la utilidad de colocarlos también a distancia sobre puntos de acupuntura(12). Una revisión de más de 20 ensayos aleatorizados informó que con TENS se conseguía disminuir la analgesia postoperatoria en un 25%(67).
La crioterapia consiste en rodear la muñeca intervenida con compresas frías, aire refrigerado o dispositivos de circulación de fluidos, reduciendo la temperatura del tejido, el edema y el dolor resultante. Los distintos estudios realizados han obtenido resultados variables, sin llegar a un consenso que respalde el beneficio de la crioterapia sobre la terapia sin aplicar frío, en términos de dolor o uso total de analgésicos(12). Tampoco se ha encontrado evidencia de la utilidad de la crioterapia asociada a la compresión(68).
Por último, a pesar de que algunos estudios promulgan su uso, la evidencia con respecto a la utilidad de la acupuntura y el masaje en la reducción de dolor postoperatorio en adultos y su efecto sobre la reducción del uso de analgésicos es contradictoria, no existiendo argumentos suficientes para recomendarlos.
Conclusiones
El desarrollo de las técnicas quirúrgicas artroscópicas de muñeca es relativamente reciente. Son varios los factores que han favorecido este progreso. La mejora de las técnicas anestésicas y los nuevos abordajes analgésicos han desempeñado un importante papel. No obstante, siguen sin existir estudios ni guías para el manejo específico del dolor en los procedimientos artroscópicos de muñeca y mano.
Dentro del manejo preoperatorio, existe controversia sobre el momento adecuado del comienzo de la terapia analgésica. No hay estudios disponibles que demuestren si existe o no una superioridad de la analgesia administrada antes de la cirugía. En el manejo intraoperatorio, el plan anestésico incluye técnicas inhalatorias, intravenosas o regionales (periféricas o neuroaxiales). La elección de la técnica anestésica depende de las características del paciente, de las patologías asociadas y de la localización y la duración estimada del procedimiento específico(1).
De entre las distintas técnicas, la mayoría de los autores siguen recomendando el uso del bloqueo anestésico. Los supraclaviculares, infraclaviculares y los axilares son los más adecuados para estas cirugías. Entre las estrategias terapéuticas de control del dolor postoperatorio destaca, por su demostrada eficiencia, la conocida como analgesia multimodal, que puede aplicarse en todas las etapas perioperatorias. Los analgésicos orales son los pilares del control analgésico una vez que el paciente sale del hospital. Los medicamentos prescritos deben cumplir los objetivos de permitir al paciente realizar las actividades normales de su vida diaria, producir mínimos efectos secundarios, no interferir con el proceso de curación y cicatrización, y ser fáciles de manejar por el paciente(1). Por último, además de las medidas farmacológicas, se deben considerar las medidas físicas en el manejo postoperatorio del dolor. Aunque no hay evidencia científica sólida que avale la mayoría de ellas, todas son seguras y prácticamente no conllevan ningún riesgo para el paciente.
Puesto que se sabe que diferentes procedimientos quirúrgicos requieren enfoques específicos para el manejo del dolor debido a las diversas características del dolor, incluida la naturaleza (somática o visceral), el lugar, la intensidad y la duración del dolor, y las diferentes consecuencias de un alivio del dolor inadecuado o inapropiado, sería altamente recomendable que se realizasen estudios y se elaborasen guías específicas para el manejo del dolor en los procedimientos artroscópicos de muñeca y mano.
Información del artículo
Cita bibliográfica
Autores
Fernando Polo Simón
Unidad de Cirugía de la Mano y del Miembro Superior. Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario HM Montepríncipe. Universidad San Pablo CEU. Boadilla del Monte, Madrid.
Servicio de Cirugía Ortopédica y Traumatología. Mutua Universal. Madrid
Víctor Triviño Sánchez-Mayoral
Unidad de Cirugía de la Mano y Microcirugía. Hospital Universitario HM Montepríncipe. Boadilla del Monte, Madrid
Alfonso Carlos Prada Cañizares
Unidad de Cirugía de la Mano y Microcirugía. Hospital Universitario HM Montepríncipe. Boadilla del Monte, Madrid
Hospital Universitario 12 de Octubre, Madrid, España
Pedro José Delgado Serrano
Unidad de Cirugía de la Mano y Microcirugía. Hospital Universitario HM Montepríncipe. Boadilla del Monte, Madrid
Responsabilidades éticas
Conflicto de interés. Los autores declaran no tener ningún conflicto de interés.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Agradecimientos
Al Dr. Ignacio Pinazo Osuna y la enfermera Ruth García Carmona, del Servicio de Anestesia del Hospital Nuestra Señora del Rosario de Madrid, por sus consejos científicos y su colaboración en la búsqueda bibliográfica.
Referencias bibliográficas
-
1Ketonis C, Ilyas AM, Liss F. Pain management strategies in hand surgery. Orthop Clin North Am. 2015;46(3):399-408.
-
2Lanitis S, Mimigianni C, Raptis D, et al. The impact of educational status on the postoperative perception of pain. Korean J Pain. 2015;28(4):265-74.
-
3Wu CL, Berenholtz SM, Pronovost PJ, et al. Systematic review and analysis of postdischarge symptoms after outpatient surgery. Anesthesiology. 2002;96(4):994-1003.
-
4Malik OS, Kaye AD, Urman RD. Perioperative hyperalgesia and associated clinical factors. Curr Pain Headache Rep. 2017;21:4.
-
5Warrender WJ, Syed UAM, Hammoud S, et al. Pain management after outpatient shoulder arthroscopy: a systematic review of randomized controlled trials. Am J Sports Med. 2017;45(7):1676-86.
-
6Jin F, Chung F. Multimodal analgesia for postoperative pain control. J Clin Anesth. 2001;13(7):524-39.
-
7Pozek JJ, De Ruyter M, Khan TW. Comprehensive acute pain management in the perioperative surgical home. Anesthesiol Clin. 2018;36(2):295-307.
-
8Moiniche S, Kehlet H, Dahl JB. A qualitative and quantitative systematic review of preemptive analgesia for postoperative pain relief: the role of timing of analgesia. Anesthesiology. 2002;96(3):725-41.
-
9Argoff. Recent management advances in acute postoperative pain. Pain Pract. 2014;14(5):477-87.
-
10Huang YM, Wang CM, Wang CT, et al. Perioperative celecoxib administration for pain management after total knee arthroplasty: a randomized, controlled study. BMC Musculoskelet Disord. 2008;9:77.
-
11Giuliani E, Bianchi A, Marcuzzi A, et al. Ibuprofen timing for hand surgery in ambulatory care. Acta Ortop Bras. 2015;23(4):188-91.
-
12Neumeister EL, Beason AM, Thayer JA, et al. Perioperative pain management in hand and upper extremity surgery. Clin Plastic Surg. 2020;47(2):323-34.
-
13D'Alessio JG, Rosemblum M, Shea KP, et al. A retrospective comparison of interscalene block and general anesthesia for ambulatory surgery shoulder arthroscopy. Reg Anesth. 1995;20(1):62-8.
-
14Brown AR, Weiss R, Greenberg C, et al. Interscalene block for shoulder arthroscopy: comparison with general anesthesia. Arthroscopy. 1993;9(3):295-300.
-
15Chan VW, Peng PW, Kaszas Z, et al. A comparative study of general anesthesia, intravenous regional anesthesia, and axillary block for outpatient hand surgery: clinical outcome and cost analysis. Anesth Analg. 2001;93(5):1181-4.
-
16McCartney CJL, Brull R, Chan VWS, et al. Early but not long-term benefit of regional compared with general anesthesia for ambulatory hand surgery. Anesthesiology. 2004;101(2):461-7.
-
17Chou R, Gordon DB, de Leon-Casasola OA, et al. Management of postoperative pain: a clinical practice guideline from the American Pain Society, the American Society of Regional Anesthesia and Pain Medicine, and the American Society of Anesthesiologists' Committee on Regional Anesthesia, Executive Committee, and Administrative Council. J Pain. 2016;17(2):131-57.
-
18Joshi G, Gandhi K, Shah N, et al. Peripheral nerve blocks in the management of postoperative pain: challenges and opportunities. Journal Clin Anesth. 2016;35:524-9.
-
19Brummett CM, Williams BA. Additives to local anesthesics for peripheral nerve blockade. Int Anesthesiol Clin. 2011;49(4):104-16.
-
20Liu Q, Chelly JE, Williams JP, et al. Impact of peripheral nerve block with low dose local anesthetics on analgesia and functional outcomes following total knee arthroplasty: a retrospective study. Pain Med. 2015;16(5):998-1006.
-
21Ardon AE, Prasad A, McClain RL, et al. Regional anesthesia for ambulatory anesthesiologists. Anesthesiol Clin. 2019;37(2):265-87.
-
22Widmer B, Lustig S, Scholes CJ, et al. Incidence and severity of complications due to femoral nerve blocks performed for knee surgery. Knee. 2013;20:181-5.
-
23Compere V, Rey N, Baert O, et al. Major complications after 400 continuous popliteal sciatic nerve blocks for post-operative analgesia. Acta Anaesthesiol Scand. 2009;53:339-45.
-
24Morau D, Ahem S. Management of local anesthetic toxicity. Int Anesthesiol Clin. 2010;48:117-40.
-
25Abrahams MS, Aziz MF, Fu RF, et al. Ultrasound guidance compared with electrical neurostimulation for peripheral nerve block: a systematic review and meta-analysis of randomized controlled trials. Br J Anaesth. 2009;102:408-17.
-
26Salinas Fv, Joseph RS. Peripheral nerve blocks for ambulatory surgery. Anesthesiol Clin. 2014;32:341-55.
-
27Binham AE, Fu R, Horn JL, et al. Continuous peripheral nerve block compared with single-injection peripheral nerve block: a systematic review and meta-analysis of randomized controlled trials. Reg Anesth Pain Med. 2012;37:583-94.
-
28Aguirre J, Del Moral A, Cobo I, et al. The role of continuous peripheral nerve blocks. Anesthesiol Res Pract. 2012;2012:560879.
-
29Greengrass RA, Nielsen KC. Management of peripheral nerve block catheters at home. Int Anesthesiol Clin. 2005;43:79-87.
-
30Marhofer D, Marhofer P, Triffterer L, et al. Dislocation rates of perineural catheters: a volunteer study. Br J Anaesth. 2013;111:800-6.
-
31Ilfeld BM. Continuous peripheral nerve blocks: a review of the published evidence. Anesth Analg. 2011;113:904-25.
-
32Aveline C, Le Hetet H, Le Roux A, et al. Perineural ultrasound-guided catheter bacterial colonization: a prospective evaluation in 747 cases. Reg Anesth Pain Med. 2011;36:579-84.
-
33Rolf C. Knee arthroscopy under local anaesthesia. Hong Kong J Orthop Surg. 1998;2(2):158-63.
-
34Rolf C, Saro C, Engsträm B, et al. Ankle arthroscopy under local anaesthesia for diagnostic evaluation and treatment. Scand J Med Sci Sports. 1996;6:255-8.
-
35Koo SCJJ, Ho PC. Wrist Arthroscopy Under Portal Site Local Anesthesia Without Tourniquet and Sedation. Hand Clin. 2017;33(4):585-91.
-
36Karaoglu S, Dogru K, Kabak S, et al. Effects of epinephrine in local anesthetic mixtures on hemodynamics and view quality during knee arthroscopy. Knee Surg Sports Traumatol Arthrosc. 2002;10(4):226-8.
-
37Krunic AL, Wang LC, Soltani K, et al. Digital anesthesia with epinephrine: an old myth revisited. J Am Acad Dermatol. 2004;51(5):755-9.
-
38Thomson CJ, Lalonde DH, Denkler KA, et al. A critical look at the evidence for and against elective epinephrine use in finger. Plast Reconstr Surg. 2007;119(1):260-6.
-
39Liu B, Yew C, Arshad MS, et al. Wide-awake wrist and small joints arthroscopy of the hand. Hand Clin. 2019;85-92.
-
40Mak MCK, Ho PC, Tse WL, et al. Arthroscopic resection of wrist ganglion arising from the lunotriquetral joint. J Wrist Surg.2013;2:355-8.
-
41Agrawal Y, Russon K, Chakrabarti I, et al. Intra-articular and portal infiltration versus wrist block for analgesia after arthroscopy of the wrist. Bone Joint J. 2015;97-B:1250-6.
-
42Ong MTY, Ho PC, Wong CWY, et al. Wrist arthroscopy under portal site local anesthesia (PSLA) without tourniquet. J Wrist Surg. 2012;1:149-52.
-
43Hagert E, Lalonde DH. Wide-awake wrist arthroscopy and open TFCC repair. J Wrist Surg. 2012;1(01):55-60.
-
44Cobo_Molinos J, Poncela-García M, Marchal-Corrales JA, et al. Effect of levobupivacaine on articular chondrocytes: an in-vitro investigation. Eur J Anaesthesiol. 2014;31:635-9.
-
45Chu CR, Izzo NJ, Coyle CH, et al. The in vitro effects of bupivacaine on articular chondrocytes. J Bone Joint Surg (Br). 2008;90-B:814-20.
-
46Chu CR, Coyle CH, Chu CT, et al. In vivo effects of single intra-articular injection of 0,5% bupivacaine or articular cartilage. J Bone Joint Surg (Am). 2010;92-A:599-608.
-
47Dogan N, Erdem AF, Erman Z, et al. The effects of bupivacaine and neostigmine or articular cartilage and synovium in the rabbit knee joint. J Int Med Res. 2005;32(5):513-9.
-
48Lalonde D. Reconstruction of the hand with wide awake surgery. Clin Plast Surg. 2011;38(4):761-9.
-
49Hansen TB, Jacobsen IA. Intra-articular bupivacaine as treatment for postoperative pain after arthroscopy of the wrist. Scand J Plast Reconstr Surg Hand Surg. 2008;42:313-5.
-
50Claxton AR, McGuire G, Chung F, et al. Evaluation of morphine versus fentanyl for postoperative analgesia after ambulatory surgical procedures. Anesth Analg. 1997;84(3):509-14.
-
51Zhang WY, Li Wan Po A. Analgesic efficacy of paracetamol and its combination with codeine and caffeine in surgical pain: a meta-analysis. J Clin Pharm Ther. 1996;21(4):261-82.
-
52Rawal N, Hylander J, Nydahl PA, et al. Survey of postoperative analgesia following ambulatory surgery. Acta Anaesthesiol Scand. 1997;41(8):1017-22.
-
53Yaksh TL, Malmberg AB. Spinal actions of NSAIDS in blocking spinally mediated hyperalgesia: the role of cyclooxygenase products. Agents Actions Suppl. 1993;41:89-100.
-
54Vane. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. Nature New Biol. 1971;231(25):232-5.
-
55Romsing J, Moiniche S. A systematic review of COX-2 inhibitors compared with traditional NSAIDs, or different COX-2 inhibitors for post-operative pain. Acta Anaesthesiol Scand. 2004;48(5):525-46.
-
56Yancey DL, Calamia KT. Use of COX-II inhibitors for hand surgery patients. J Hand Surg Am. 2008;33(10):1909-10.
-
57Bowers MR, Pulos N, Pulos PB, et al. Opioid-sparing pain management in upper extremity surgery. Part 2: surgeon as prescriber. J Hand Surg Am. 2019;44(10):878-82.
-
58Thomas DA, Boominathan P, Goswami J, et al. Perioperative management of patients with addiction to opioid and non-opioid medications. Curr Pain Headache Rep. 2018;22(7):52.
-
59Lorenzetti BB, Ferriera SH. Mode of analgesic action of dipyrone: direct antagonism of inflammatory hyperalgesia. Eur J Pharmacol. 1985;114:375-81.
-
60Carlsson KH, Helmreich J, Jurna I. Comparison of central antinociceptive and analgesic effects of pyrazolone derivatives, metamizol (dipyrone) and aminophenazone (“pyramidon”). Schmerz Pain Douleur. 1986;7:93-100.
-
61Rawal N, Allvin R, Amilon A, et al. Postoperative analgesia at home after ambulatory hand surgery: a controlled comparison of Tramadol, Metamizol, and Paracetamol. Anesth Analg. 2001;92:347-51.
-
62Caraco Y, Sheller J, Wood AJJ. Pharmacogenetic determination of the effects of codeine and prediction of drug interactions. J Pharmacol Exp Ther. 1996;278:1165-74.
-
63Raffa RB, Friderichs E, Reinmann W, et al. Opioid and nonopioid components independently contribute to the mechanism of action of tramadol, an "atypical" opioid analgesic. J Pharmacol Exp Ther. 1992;260:275-85.
-
64Tarkkila P, Tuominem M, Lingred L. Comparison of respiratory effects of tramadol and pethidine. Eur J Anaesthesiol. 1998;15:64-8.
-
65Wilder-Smith CH, Bettiga A. The analgesic tramadol has minimal effect on gastrointestinal motor function. Br J Clin Pharmacol. 1997;43:71-5.
-
66Rawal N. Postoperative pain treatment for ambulatory surgery. Best Prac Res Clin Anaesthesiol. 2007;21(1):129-48.
-
67Bjordal JM, Johnson MI, Ljunggreen AE. Transcutaneous electrical nerve stimulation (TENS) can reduce postoperative analgesic consumption. A meta-analysis with assessment of optimal treatment parameters for postoperative pain. Eur J Pain. 2003;7(2):181-8.
-
68Meyer-Marcotty M, Jungling O, Vaske B, et al. Standarized combined cryotherapy and compression using Cryo/Cuff after wrist arthroscopy. Knee Surg Sports Traumatol Arthrosc. 2011;19:314-9.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- La importancia del control del dolor
- Aprendiendo del dolor para mejorar al paciente
- Manejo perioperatorio del dolor en cirugía artroscópica de hombro
- Manejo perioperatorio del dolor en artroscopia de codo
- Analgesia perioperatoria en cirugía artroscópica de muñeca y mano
- Analgesia perioperatoria en artroscopia de cadera
- Analgesia perioperatoria en cirugía artroscópica de rodilla
- Manejo perioperatorio del dolor en artroscopia de tobillo
- Dolor neuropático posquirúrgico en traumatología
- Técnica de aplicación del parche de capsaicina 179 mg
- SLAP de tipo 3: desgarro en asa de cubo
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.