Conceptos biomecánicos de la cirugía reconstructiva del ligamento cruzado anterior
Biomechanic concepts in reconstructive surgery involving the anterior cruciate ligament
Resumen:
Objetivo: Relacionar los postulados de la biomecánica del ligamento cruzado (LCA) con los diferentes modelos de su reconstrucción quirúrgica. Existen 3 modelos de reconstrucción del LCA: reconstrucción monofascicular siguiendo los preceptos isométricos y ocupando la región proximal de la huella femoral; reconstrucción monofascicular ocupando el centro de la huella femoral deseando minimizar la inestabilidad rotacional residual; y reconstrucción mediante doble fascículo en la que se duplican los elementos estabilizadores al colocar 2 fascículos biomecánicamente diferenciados. Los metaanálisis sugieren que la cirugía de reconstrucción del LCA mediante de doble fascículo resulta superior con mediciones objetivas, aunque los resultados funcionales subjetivos fueron similares a los de las reconstrucciones monofasciculares. También la cirugía de doble fascículo provoca mayores índices de retorno a niveles de actividad prelesional y un menor índice de nuevas lesiones meniscales o nuevas lesiones de LCA. Sin embargo, a pesar de las aparentes ventajas, son minoría los cirujanos que acometen la reconstrucción bifascicular.
Abstract:
Objectives: Connecting the premises of anterior cruciate ligament (ACL) biomechanics to the different types of surgical reconstruction models used. There are currently 3 ACL reconstruction models: single-bundle reconstructions following isometric precepts and occupying the proximal region of the femoral footprint; single-bundle reconstructions that occupy the centre of the femoral footprint and whose aim is to minimise residual rotational instability; and reconstruction techniques using a double-bundle on which stabilisers are duplicated subsequently to placing bundles biomechanically. From a scientific perspective, meta-analyses suggest that ACL reconstructive surgery using a double bundle is superior in terms of objective measurements, although subjective functional outcomes were similar to those produced by single-bundle reconstructive approaches. Double-bundle surgery, moreover, produces higher rates of a return to pre-lesion activity levels and a lower incidence of new lesions involving the meniscus or the ACL. However, and in spite of these apparent advantages, only a minority of surgeons actually perform double bundle reconstruction techniques.
Introducción
La función articular de la rodilla está regulada pasivamente por la forma de los huesos y por el trabajo armónico de la cápsula y los ligamentos. Estos estabilizan la articulación permitiendo su movilidad y previniéndola de movimientos anormales. En este contexto funcional, el ligamento cruzado anterior (LCA) tiene como principal función impedir el desplazamiento anterior de la tibia respecto al fémur. La inestabilidad anterior de la rodilla secundaria a la lesión del LCA es abordada actualmente por la cirugía ortopédica mediante una ligamentoplastia intraarticular con el objetivo de restaurar este patrón de movimiento fisiológicamente estable de la rodilla. Idealmente, la plastia ha de reflejar las características anatómicas y el comportamiento biomecánico (forma y función) del LCA original al que sustituye.
Los aspectos anatómicos y biomecánicos del LCA permanecen en continua revisión. De manera acoplada en el tiempo, el desarrollo tecnológico proporciona al cirujano mejor instrumentación y nuevos dispositivos de fijación que facultan nuevas técnicas. Cerrando el círculo, estas nuevas técnicas permiten rediseñar la manera de imitar la forma y la función del LCA nuevamente. Pero, con casi 15 años de diferencia, la bibliografía sigue reflejando que la causa más frecuente de fracaso en la cirugía reconstructiva del LCA son los errores técnicos secundarios a la malposición de los túneles(1)(2). Y estos errores en la elección de la posición de los túneles son 3 veces más frecuentemente cometidos en el fémur que en la tibia(3). Según esta observación, es el propio cirujano el responsable de la mayoría de los éxitos de la cirugía reconstructiva del LCA, pero también el de los fracasos. Esta afirmación obliga al cirujano ortopédico a revisar constantemente el estado de la ciencia y el pulso de los avances tecnológicos.
Anatomía funcional
El LCA es una estructura intraarticular y extrasinovial situada en la escotadura intercondílea de la rodilla(4). Su inserción proximal se sitúa en la porción más posterior de la cara interna del cóndilo femoral externo. Discurre oblicuamente abriéndose en abanico hacia su inserción distal entre las espinas tibiales.
Estructuralmente está compuesto por fibras de colágeno rodeadas de tejido conjuntivo laxo y tejido sinovial sin subdivisión histológica fascicular. La precaria vascularización del LCA depende fundamentalmente de la arteria geniculada media(5). Pero la realidad es mucho más variada que la precedente descripción clásica.
Los estudios muestran una gran variabilidad de formas y tamaños(6)(7)(8)(9), tanto de las áreas insercionales como de las longitudes de los cuerpos de los ligamentos.
La huella insercional femoral es aproximadamente oval, con un diámetro mayor de 18 ± 2 mm y un diámetro menor de 11 ± 2 mm(4). El valor de su superficie varía desde los 83 mm2(7) a los 197 mm2(9). Hay un relieve distintivo del borde anterior de la huella, la cresta intercondilar o cresta “del residente”, que es el límite anterior de la huella. A veces es reconocible un relieve óseo transversal, cresta bifurcada, en la huella que separa las inserciones de los fascículos principales(9).
El área más proximal y posterior de la huella femoral recibe la inserción del conjunto de fibras más anteromediales que surgen en la tibia y que reciben el nombre de fascículo anteromedial (FAM) (Figura 1). En el otro extremo de la huella, en una subárea más distal y levemente anterior, se insertan las fibras más posterolaterales surgidas en la tibia, que reciben el nombre de fascículo posterolateral (FPL)(7). Se han reconocido hasta 3 estructuras fasciculares(1)(10)(11). Sin datos uniformes sobre la distribución de las áreas respectivas, parece ligeramente mayor la del FAM que la del FPL (52 frente a 48%, respectivamente)(7)(8).
figura-1.jpg
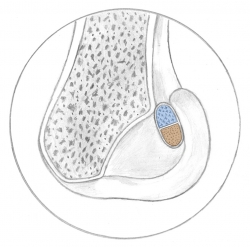
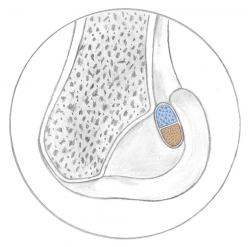
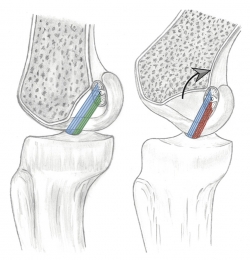
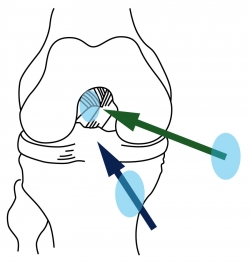
Figura 1. En la región proximal de la huella (azul) se insertan las fibras surgidas del área anteromedial de la tibia, correspondientes al fascículo anteromedial. En la región distal de la huella (rojo) se insertan las fibras del área posterolateral de la tibia, correspondientes al fascículo posterolateral.
El área de inserción tibial tiene su eje mayor orientado en sentido anteroposterior(4). Su longitud es de 17 ± 3 mm y su anchura de 11 ± 2 mm. La medición de su superficie muestra un rango de 114 a 229 mm2(8), siendo también ligeramente mayor el área del FAM.
El LCA tiene una longitud media de 32 (rango: 22-41) mm(8). El FAM es más largo que el FPL(12). El diámetro de la sección en el tercio medio tiene un rango de 7-12 mm(1)(13). El área de la sección del tercio medio del LCA es aproximadamente la tercera parte que el área de sus inserciones óseas(14).
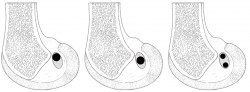
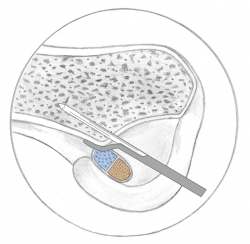
En una reconstrucción monofascicular (RMF) y suponiendo una superficie circular, para una plastia de 9 mm de diámetro, se genera una ocupación de la huella de 63,5 mm2. Las reconstrucciones mediante doble fascículo (RDF), frente a lo que pudiera parecer, no realizan más ocupación de la huella. Colombet et al.(15), exponiendo su RDF, muestran los diámetros más frecuentes de los tendones de la pata de ganso extraídos y doblados sobre sí mismos (recto interno: 5 mm; semitendinoso: 7 mm). Utilizando la misma lógica anterior y suponiendo 2 áreas circulares, la superficie de ocupación de la huella en la RDF es de 58,11 mm2. Parece cierto afirmar, con independencia del modelo de reconstrucción utilizado, que apenas se utiliza la mitad de la huella insercional original (Figura 2). Si la huella femoral original ofrece casi el doble de espacio, parece lógico preguntarse si la ocupación que se realiza tiene algún efecto biomecánico. En este punto, conviene apuntar que no parece que haya relación entre el tamaño de los tendones extraídos y las huellas insercionales(13). Esta observación reafirma la dificultad de reproducir la anatomía original. Además, las propias rodillas son constitucionalmente diferentes en tamaño. Esto provoca que en ocasiones se realizan reconstrucciones monofasciculares de diámetros similares, en pacientes con diferente talla o índice de masa corporal.
figura-2-ver-cual-de-las-dos.jpg
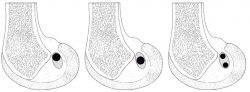
Figura 2. A: reconstrucción monofascicular ocupando el área proximal de la huella femoral (ocupación parcial de la huella original); B: reconstrucción monofascicular ocupando el área central de la huella femoral (ocupación parcial de la huella original); C: reconstrucción mediante 2 fascículos (ocupación parcial de la huella original).
En la posición de rodilla extendida, el FPL está en su máxima tensión. Según se avanza en la flexión, este fascículo se va relajando, mientras que el FAM se tensa progresivamente(16)(17). Sin embargo, coexistiendo con esta observación de patrón alternante, el LCA permanece funcional durante todo el rango de movimiento (RDM). La traducción clínica de esta subdivisión funcional fue expresada por Furman et al.(18) en su estudio con cortes secuenciales y selectivos de los FAM y FPL. La sección del FPL favorecía la positividad de la maniobra de Lachman permaneciendo negativa la del “cajón anterior”. La sección completa del LCA conduce a una inestabilidad rotacional evidente (maniobra del pivot-shift positiva).
Isometría del ligamento cruzado anterior
La isometría significa estado de longitud constante. Aunque la realidad es más compleja, la isometría ha sido la referencia biomecánica de las reconstrucciones del LCA hasta entrar en el siglo XXI(19). Determinada por la elección de los puntos de anclaje tanto en el fémur como en la tibia, la isometría supone un estado de longitud constante de las fibras de la plastia durante el RDM(20). En consecuencia, la tensión sobre la plastia es uniforme durante el arco de movilidad.
El tejido del LCA pierde sus propiedades plásticas si se estira por encima del 20% de su longitud. Admitiendo que la longitud media del LCA según varias series es de 32 mm, el LCA podría estirarse hasta 6 mm sin romperse(21). Pero la naturaleza viscoelástica del tejido en condiciones de estiramientos cíclicos solo permite una elongación del 6% (eso representa una elongación de 2 mm) antes de provocarse una deformidad permanente del LCA(22).
El objetivo de una reconstrucción isométrica es evitar las complicaciones de 2 situaciones posibles y opuestas: una plastia no isométrica con una distancia entre sus inserciones que varía durante el RDM. Cuando la plastia se fija en el momento del RDM en el que su distancia es la corta, sufrirá un exceso de tensión en el otro extremo del RDM. Este hecho puede traducirse en una limitación RDM o en una deformidad por encima de sus propiedades elásticas que elongará la plastia de manera definitiva. Eventualmente, este exceso de tensión puede superar la capacidad de agarre del dispositivo de fijación. Si, por el contrario, la plastia se fija en el punto del RDM en el que la distancia entre sus inserciones es la más larga, en el otro segmento del RDM estará distendida sin cumplir su función de estabilización ni prevención de movimientos anormales en la rodilla.
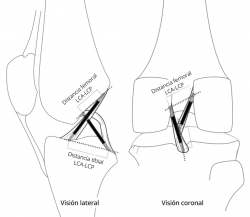
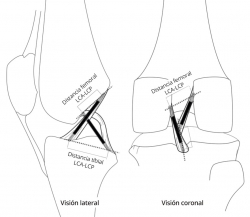
Según el modelo de 4 barras cruzadas de Bradley et al.(23), se puede explicar el movimiento en 2 planos de la rodilla mediante la isometría de su fibra central. En este modelo, el LCA está integrado con el ligamento cruzado posterior, en una unidad de estabilización central de la rodilla. Aunque es una simplificación, en el plano de esta unidad de estabilización central es relativamente válido el modelo teórico de dispositivo cruzado de 4 barras propuesto por Bradley et al.(23) para explicar asociados el movimiento de flexoextensión y el de la rodadura. Las 2 barras que se cruzan representan a los ligamentos cruzados tendidos en línea recta, suponiéndose su isometría. Las otras 2 barras representan a la distancia entre las inserciones de los ligamentos cruzados en cada hueso y se ha demostrado que existe una relación constante entre ellas medible mediante resonancia magnética (RM)(24) (Figura 3). Sin embargo, Amis et al.(25) tomaron en consideración que la plastia real no es una línea. La fibra central de la plastia puede ser isométrica si se inserta justo en el eje de rotación. Pero todas las fibras adyacentes, al verse afectadas por su distancia al eje de giro, presentan cambios de longitud con el movimiento. En consecuencia, el comportamiento biomecánico de la plastia no se explica por su fibra central. Afirman que los cambios de longitud de las fibras se relacionan con una cambiante participación en la acción global de la plastia (Figura 4). El cirujano debe estar alertado de que la plastia sustituta del LCA tenga durante el RDM un acotado rango de cambio de longitud esperable denominado “comportamiento isométrico”. Por lo tanto, el “comportamiento isométrico” de la plastia es una alteración en su longitud menor de 2 mm durante el RDM de la rodilla(22)(26). La variabilidad de la localización del túnel en el fémur es mucho más determinante del comportamiento isométrico que las variaciones del túnel tibial(23)(27) en el “comportamiento isométrico” de la plastia.
figura-4.jpg
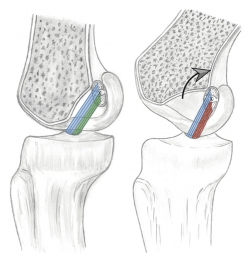
Figura 4. A: con la rodilla en extensión las fibras del fascículo anteromedial (azul) y posterolateral (verde) están tensas; B: con la flexión de la rodilla, las fibras anteromediales (azul) mantienen su tensión pero las fibras posterolaterales (rojo) pierden su tensión por el acortamiento de sus fibras.
Se entiende que el comportamiento isométrico protege a la plastia y solicita menos al dispositivo de fijación. Existen muchos estudios biomecánicos (con metodologías diferentes), que buscan determinar el punto de la huella femoral donde practicar un túnel que permita a la plastia el comportamiento más isométrico. Con su dispositivo cruzado de 4 barras, Bradley(23) predijo, con carácter general, el comportamiento de la longitud de la plastia según la localización del anclaje femoral. Un túnel localizado anteriormente a la inserción original en el fémur (respecto a la línea de Blumensaat) provoca un aumento de la distancia entre los puntos de inserción cuando la rodilla se lleva a la flexión, y una menor distancia cuando la rodilla es llevada a la extensión.
Experimentalmente, se ha encontrado que ninguna de las subdivisiones del LCA es isométrica(25) y son las fibras AM del LCA las que tienen mejor “comportamiento isométrico”(26). Según este punto de vista bibliográfico y para favorecer el comportamiento isométrico de la plastia, la zona proximal de la huella femoral es la más adecuada para centrar un túnel femoral(22)(28).
Pero la condición de “punto isométrico” dentro de la huella femoral para diferentes autores señala a su vez a puntos diferentes. En un estudio de laboratorio, Zavras et al.(29) comparan diferentes puntos isométricos propuestos por la literatura y afirman que solo los puntos cercanos a la vertiente proximal de la línea de Blumensaat reflejan el “comportamiento isométrico” aceptado.
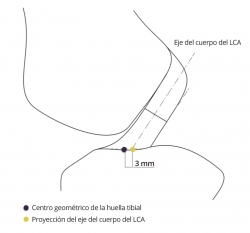
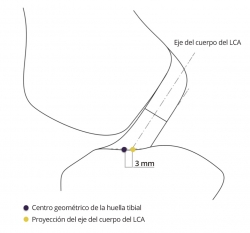
En contraste con lo referido al fémur, la localización del túnel tibial en el plano sagital tiene menos repercusión en el comportamiento isométrico(23)(27)(28). Las fibras con mejor comportamiento isométrico son las más anteriores(29). Pero la localización del túnel tibial tiene una característica específica, el posible rozamiento de la plastia que emerge de túnel tibial con el techo de la escotadura o con el borde condilar. El centro geométrico de la huella tibial se halla ligeramente anterior gracias al arremolinamiento de las fibras, que permite un contacto íntimo de la inserción tibial original con el techo de la escotadura(14). Las plastias del LCA son sustitutos rectos que no pueden reproducir este contacto adaptado de la anatomía original, pudiendo rozar con el techo de la escotadura. Para evitar el rozamiento de la plastia, se sugiere retrasar ligeramente el punto seleccionado como centro de la huella tibial para labrar el túnel tibial(30) (Figura 5).
La reconstrucción del ligamento cruzado anterior
En este ambiente bibliográfico basado en el “comportamiento isométrico” de la plastia, quedaron establecidos los principios biomecánicos de las RMF que imitan, con ligeras variaciones, al FAM del LCA original(31). Si tenemos en cuenta que el “área isométrica” es más pequeña que los sustitutos que normalmente se emplean para reemplazar al LCA lesionado, se comprenderá que realmente la isometría es una referencia quirúrgica más que un modelo de reproducción, pero que se ha demostrado válido hasta entrado el siglo XXI(32). Aunque la plastia trata, en el corto y medio plazo, el síntoma de la inestabilidad articular del paciente, puede cuestionarse la capacidad de estas reconstrucciones de evitar el progreso de la artrosis de rodilla(33). Esta progresión de la artrosis podría tener su clave en el daño meniscal asociado(34) o bien en un componente de inestabilidad rotacional residual no controlado por las RMF practicadas en las décadas anteriores(35).
Buscando minimizar este déficit rotacional, durante la primera década del presente siglo se preconizaron 2 alternativas quirúrgicas diferentes. Una es la RDF en la que se replican los 2 fascículos funcionales del LCA. De esta manera, al FAM convencional se le añade un FPL, que es el que principalmente controla la estabilidad rotacional cerca de la extensión(15). La segunda alternativa es la que se fundamenta en colocar la plastia monofascicular en el centro de la huella femoral(36)(37). Esta posición resulta más distal anatómicamente, resultando una plastia menos vertical en el plano coronal.
En la actualidad, hay planteados 3 modelos teóricos diferentes en la cirugía reconstructiva del LCA: las RMF, siguiendo los preceptos isométricos y ocupando la región proximal de la huella femoral (RMF isom); la RMF ocupando el centro de la huella femoral deseando minimizar la inestabilidad rotacional residual (RMF centro h); y, finalmente, también se ha propuesto la RDF, donde se duplican los elementos estabilizadores al colocar 2 fascículos biomecánicamente diferenciados.
Las RMF centro h parece que resuelven el dilema en el plano coronal, descendiendo la referencia horaria desde las “11” hasta las “10” (en una rodilla derecha), la localización del túnel en la huella femoral buscando su centro. Aparentemente y en teoría, parece asumible de entrada que aumentar la oblicuidad de la plastia favorece a esta el control rotacional de la rodilla. Pero el planteamiento ha de ser cauteloso. Puesto que el número de fibras de la plastia es la misma, si aumentan las fibras con poder estabilizador rotacional, quizás esté disminuido el porcentaje de fibras que tengan poder estabilizador en sentido sagital. No hay estudios que sostengan el comportamiento dual y diferente de una misma fibra. Por otra parte, los estudios biomecánicos recientes siguen manteniendo que las fibras más isométricas y más importantes biomecánicamente son las que están en la zona proximal de la huella(38)(39). Entonces, ¿por qué abandonar esta zona de la huella?.
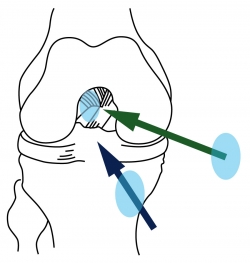
Instrumentalmente, al espacio intercondíleo con la rodilla en flexión solo se puede acceder anterógradamente desde el suelo (a través del túnel tibial) o desde la arcada anterior (por un portal anteromedial) (Figura 6). Evidentemente, entrar desde el suelo provoca una tendencia hacia la verticalización en la instrumentación.
Pero entrar desde la arcada anterior provoca una tendencia a la horizontalización. Ambas orientaciones físicas tienen servidumbres que se desarrollan a continuación.
La mayoría de las RMF durante el último tramo del siglo XX accedían a la huella femoral a través del túnel practicado en la tibia (RMF isom mediante técnica transtibial) buscando la región proximal de la huella (área AM) por el esperado comportamiento isométrico de la plastia. La referencia horaria de este gesto quirúrgico es colocar el punto de entrada del fémur a las “11” de la esfera horaria. Las guías de fémur con escalón se han desarrollado para apoyarse en el punto over the top, entendiendo este como el punto de unión del cóndilo lateral con la cortical posterior del fémur. Pero una vez apoyada la guía de aguja, un movimiento de pivote sobre este apoyo de la guía debe permitir dirigir la aguja sobre la cara medial del cóndilo lateral. Aunque la iconografía para ilustrar este gesto quirúrgico ha inducido al error(19). La Figura 7 es similar a una figura aparecida en el citado artículo de actualización. Se aprecia cómo la guía apoyada se dirige directamente hacia el techo de la escotadura. No es posible que esa plastia esté a las “11” sino a las “12” de la esfera horaria y completamente verticalizada. Acceder a la huella femoral, atravesando primero el túnel tibial, reduce la maniobrabilidad del instrumental. Y es probable que este hecho haya favorecido el error técnico más frecuente: una localización de la entrada al túnel femoral anterior o en el techo de la escotadura(1)(2).
Para acceder más libremente al centro de la huella femoral y practicar una RMF centro h, muchos cirujanos realizan el túnel femoral accediendo bien por el portal AM convencional o por un portal AM accesorio. Pero este acceso está condicionado espacialmente, pues la presencia del cóndilo interno condiciona la libre oblicuidad de la broca y, por tanto, la libre oblicuidad del túnel. Y de manera añadida, el grado de flexión de la rodilla en ese momento determina la orientación y la longitud del túnel femoral.
La traducción práctica de este hecho es la recreación de túneles femorales potencialmente cortos, oblicuos y cercanos a las estructuras posterolaterales de la rodilla(40). A 90° de flexión, las longitudes medias de los túneles realizados por el portal AM son de 27 ± 9 mm. Esta menor longitud de los túneles entra en conflicto con los dispositivos de fijación tradicionales (no ajustables y transfixiantes) que, en general, precisan mayor longitud de túnel. Colocar la plastia a las “10” puede tener alguna ventaja biomecánica en el control rotacional en los estudios de laboratorio(41). Aunque, en series de pacientes, las diferencias observadas no se encontraron en las pruebas exploratorias objetivas sino en los resultados de las escalas de valoración subjetiva(42). No se puede concluir que es inherente a la RMF isom mediante técnica transtibial posicionar una plastia a las “12” o una plastia anterior. Sería tan sesgado como afirmar que todos los túneles realizados a las “11” mediante la RMF centro h son defectuosamente cortos.
Hay varias consideraciones biomecánicas afirmadas y no cuestionadas por la bibliografía acerca de la biomecánica del LCA. Una es el comportamiento isométrico de las fibras que ocupan el área AM de la huella(26). El RDM de la rodilla provoca menos cambios de longitud en la plas- tia o solicitaciones tractoras en los dispositivos de fijación. Otra de estas consideraciones es el desglose de la función estabilizadora del LCA en 2 fascículos diferenciados(16)(38). En condiciones normales, el FAM del LCA se va tensando según avanza el RDM hacia la flexión. Por el contrario, el FPL se tensa cuando el RDM se acerca a la extensión.
La RMF centro h centra la plastia en el centro de la huella femoral (alejándose del área AM). Anatómicamente, el túnel ocupa un área más distal, pero desocupando la proximal de la huella femoral(43). Funcionalmente, se busca más control rotacional (imitando a las fibras PL del LCA original) sin aparentemente sacrificar la estabilidad anteroposterior. Pero este planteamiento puede resultar comprometido tanto bajo el punto de vista mecánico como el isométrico.
Bajo el punto de vista mecánico, la plastia que ocupa una zona más distal en la huella pone más porcentaje de fibras de la misma para estabilizar la rodilla en extensión (fibras PL). Pero lo hace reduciendo el porcentaje de fibras de la plastia que tienen que estabilizar la rodilla en flexión (fibras AM). Las fibras AM no solamente tienen un comportamiento más isométrico, como se ha dicho, sino que además asumen un papel dominante en la resistencia a la traslación anterior(39). A 90° de flexión, las fibras AM asumen el 86% de la resistencia a la traslación anterior. En ese misma posición, las fibras PL asumen solo el 9% de la resistencia a la misma traslación. Reducir el porcentaje de fibras AM de la plastia quizás provoque vulnerabilidad a la rodilla. Este hecho podría justificar el mayor riesgo de revisión de plastias en RMF centro h frente a plastias RMF isom realizadas mediante abordaje transtibial(44).
Bajo el punto de vista isométrico, alejar las fibras de la plastia del área AM las expone a alteraciones de su longitud significativas. En un reciente estudio biomecánico se registran las alteraciones de longitud de reconstrucciones del LCA combinando 3 puntos de inserción tibial y 3 puntos de inserción femoral(45).
Coincidiendo con todos los estudios previos, la reconstrucción con menos variación en la longitud entre las inserciones fue la que reproducía el haz AM (2,78 ± 0,93 mm), ubicando la plastia en el área AM del fémur y en el área AM de la tibia. Pero la reproducción de la técnica “centro de huella-centro de huella” que se postula como referencia(43) provoca una alteración de longitud de 7,63 ± 2,01 mm. Esta previsible alteración en la longitud de la plastia, como se ha citado previamente, quizás pueda favorecer el mayor índice de revisión de las RMF centro h. También coincidiendo con la bibliografía previa, este estudio refleja que las variaciones de ubicación tibial tienen menor influencia en la isometría que las femorales.
La técnica de RDF busca representar en la rodilla 2 elementos estabilizadores diferenciados(15). Cada uno de ellos ocupa un área de la huella con atribuciones biomecánicas diferentes y, en consecuencia, reproduce un comportamiento biomecánico diferente. De entrada, este planteamiento duplica el número de elementos estabilizadores respecto al único de las RMF habituales. Los estudios en laboratorio reflejan esta superioridad biomecánica(46). Aunque inicialmente la técnica dispone de 2 fascículos en 4 túneles(15), la bibliografía refleja equivalente estabilidad aunque solo se realice un único túnel tibial(47)(48). El túnel que aloja al FPL, al ser el componente que ocupa el área más distal en la huella (menos verticalizado), tiene también el riesgo de ser corto(40). Los dispositivos de fijación ajustables son perentorios para enterrar todo el FPL en la longitud de túnel conseguida. Es evidente que la técnica precisa el doble de dispositivos de fijación femoral, lo que encarece el proceso quirúrgico.
La reconstrucción del ligamento cruzado anterior: camino del futuro
Prevalece el debate sobre si la cirugía reconstructiva del LCA previene la artrosis a largo plazo. Pero es razonable asumir que el cirujano debe tratar en los pacientes el síntoma de la inestabilidad, prevenir lesiones meniscales y la necesidad de ulteriores cirugías(49). En consecuencia, llevará a cabo reconstrucciones del LCA asumiendo un “plan de ruta” quirúrgico. El comportamiento isométrico de la plastia lo sigue siendo. Pero también la tendencia actual al túnel centrado en la huella y la RDF. Bajo el punto de vista científico, los metaanálisis sugieren que la cirugía de reconstrucción del LCA mediante doble fascículo resulta superior con mediciones objetivas(50)(51)(52), aunque los resultados funcionales subjetivos fueron similares(53). También la cirugía de doble fascículo provoca mayores índices de retorno a niveles de actividad prelesional y un menor índice de nuevas lesiones meniscales o nuevas lesiones del LCA(49). Sin embargo, a pesar de las aparentes ventajas, son minoría los cirujanos que acometen la reconstrucción bifascicular.
Figuras
Figura 1. En la región proximal de la huella (azul) se insertan las fibras surgidas del área anteromedial de la tibia, correspondientes al fascículo anteromedial. En la región distal de la huella (rojo) se insertan las fibras del área posterolateral de la tibia, correspondientes al fascículo posterolateral.
Figura 2. A: reconstrucción monofascicular ocupando el área proximal de la huella femoral (ocupación parcial de la huella original); B: reconstrucción monofascicular ocupando el área central de la huella femoral (ocupación parcial de la huella original); C: reconstrucción mediante 2 fascículos (ocupación parcial de la huella original).
Figura 3. Visión lateral y coronal de un dispositivo cruzado de 4 barras tridimensional integrado en una rodilla. El cociente formado por las distancias entre las inserciones de los ligamentos cruzados en cada hueso es una constante.
Figura 4. A: con la rodilla en extensión las fibras del fascículo anteromedial (azul) y posterolateral (verde) están tensas; B: con la flexión de la rodilla, las fibras anteromediales (azul) mantienen su tensión pero las fibras posterolaterales (rojo) pierden su tensión por el acortamiento de sus fibras.
Figura 5. El eje del cuerpo del ligamento (tercio medio) resulta posterior (punto amarillo) al centro geométrico del área de inserción de la tibia (punto morado).
Figura 6. Al espacio intercondíleo se puede acceder anterógradamente a través de un túnel tibial (flecha azul) o desde la arcada anterior (flecha verde).
Información del artículo
Cita bibliográfica
Autores
Iñaki Mediavilla
Servicio de Cirugía Ortopédica y Traumatología. Hospital de Basurto. Bilbao, Bizkaia
Universidad del País Vasco. Bilbao
Mikel Aramberri
Hospital Universitario Ramón y Cajal. Madrid
José Antonio Guerrero
Hospital Universitario de Cruces. Barakaldo, Bizkaia
Francesc Soler Romagosa
Presidente de la AEA
Servicio de Cirugía Ortopédica y Traumatología. Mutua Egarsat. Terrassa. Barcelona
Secretario de la Junta Directiva de la Asociación Española de Artroscopia
Editor Asociado de REACA
Miembro del Grupo Traumadvance. Terrassa, Barcelona
Responsabilidades éticas
Conflicto de interes. Los autores declaran no tener ningún conflicto de intereses.
Financiación. Este trabajo no ha sido financiado.
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Referencias bibliográficas
-
1Aglietti P, Buzzi R, Giron F, Simeone AJ, Zaccherotti G. Arthroscopic-assisted anterior cruciate ligament reconstruction with the central third patellar tendon. A 5-8-year follow-up. Arthroscopy. 1997;5:138-44.
-
2MARS Group, Wright RW, Huston LJ, Spindler KP, Dunn WR, Haas AK, et al. Descriptive epidemiology of the Multicenter ACL Revision Study (MARS) cohort. Am J Sports Med. 2010;38:1979-86.
-
3Trojani C, Sbihi A, Djian P, Potel JF, Hulet C, Jouve F, et al. Causes for failure of ACL reconstruction and influence of meniscectomies after revision. Knee Surg Sports Traumatol Arthrosc. 2011;19:196-201.
-
4Odenstein M, Gillquist J. Functional anatomy of the anterior cruciate ligament and a rationale for reconstruction. J Bone Joint Surg (Am). 1985;67-A:257-62.
-
5Larson RL, Tailon M. Anterior Cruciate Ligament Insufficiency: Principles of Treatment. J Am Acad Orthop Surg. 1994;2:26-35.
-
6Edwards A, Bull AM, Amis AA. The attachments of the anteromedial and posterolateral fibre bundles of the anterior cruciate ligament. Part 2: Femoral attachment. Knee Surg Sports Traumatol Arthrosc. 2008;16:29-36.
-
7Siebold R, Ellert T, Metz S Metz J. Femoral insertions of the anteromedial and posterolateral bundles of the anterior cruciate ligament: morphometry and arthroscopic orientation models for double-bundle bone tunnel placement—a cadaver study. Arthroscopy. 2008;24:585-92.
-
8Kopf S, Musahl V, Tashman S, Szczodry M, Shen W, Fu FH. A systematic review of the femoral origin and tibial insertion morphology of the ACL. Knee Surg Sports Traumatol Arthrosc. 2009;17:213-9.
-
9Ferretti M, Ekdahl M, Shen W, Fu FH. Osseous landmarks of the femoral attachment of the anterior cruciate ligament: an anatomic study. Arthroscopy. 2007;23:1218-25.
-
10Girgis FG, Marshall JL, Al Monajem ARS. The cruciate ligaments of the knee joint: anatomical, functional and experimental analysis. Clin Orthop Rel Res. 1975;106:21-31.
-
11Norwood LA, Cross MJ. Anterior cruciate ligament: functional anatomy of its bundles in rotatory instabilities. Am J Sports Med. 1979;7:23-6.
-
12Zantop T, Petersen W, Sekiya JK, Musahl V, Fu FH. Anterior cruciate ligament anatomy and function relating to anatomical reconstruction. Knee Surg Sports Traumatol Arthrosc. 2006;14:982-92.
-
13Iriuchishima T, Ryu K, Yorifuji H, Aizawa S, Fu FH. Commonly used ACL autograft areas do not correlate with the size of the ACL footprint or the femoral condyle. Knee Surg Sports Traumatol Arthrosc. 2014;22:1573-9.
-
14Howell SM, Clark JA, Farley TE. A rationale for predicting anterior cruciate graft impingement by the intercondylar roof. A magnetic resonance imaging study. Am J Sports Med. 1991;19:276-82.
-
15Colombet P, Robinson J, Jambou S, Allard M, Bousquet V, de Lavigne C. Two-bundle, four- tunnel anterior cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc. 2005;9:1-8.
-
16Norwood LA, Cross MJ. Anterior cruciate ligament: functional anatomy of its bundles in rotatory instabilities. Am J Sports Med 1979; 7: 23-6.
-
17Sakane M, Fox RJ, Woo SL-Y, Livesay GA, Li G, Fu FH. In situ forces in the anterior cruciate ligament and its bundles in response to anterior tibial loads. J Orthop Res 1997;15:285- 293.
-
18Furman W, Marshall JL, Girgis FG. The Anterior Cruciate Ligament. A Functional Analysis Based on Postmortem Studies. J Bone Joint Surg (Am). 1976;58-A:179-85.
-
19Fineberg MS, Zarins B, Sherman OH. Practical considerations in anterior cruciate ligament replacement surgery. Arthroscopy. 2000;16:715-24.
-
20Sidles JA, Larson RV, Garbini JL, Downey DJ, Matsen FA. Ligament length relationships in the moving knee. J Orthop Res. 1988;6:593-610.
-
21Amis AA, Zavras TD. Isometricity and graft placement during anterior cruciate ligament reconstruction. Knee. 1995;2:5-17.
-
22Penner DA, Daniel DM, Wood P, Mishra D. An in vitro study of anterior cruciate ligament graft placement and isometry. Am J Sports Med. 1988;16:238-43.
-
23Bradley J, FitzPatrick D, Daniel D, Shercliff T, O’Connor J. Orientation of the cruciate ligament in the sagittal plane: a method of predicting its length-change with flexion. J Bone Joint Surg (Br). 1988;70-B:94-9.
-
24Hernaiz A, Mediavilla I, Usabiaga J, Diez F. Anthropometry of cruciate ligaments in the knee: MRI study. Eur J Anat. 2017;21. [Epub ahead of print].
-
25Amis AA, Dawkins GP. Functional anatomy of the anterior cruciate ligament: fibre bundle actions related to ligament replacement and injuries. J Bone Joint Surg (Br). 1991;73-B:260-7.
-
26Sapega AA, Moyer RA, Schneck C, Komalahiranya N. Testing for isometry during reconstruction of the anterior cruciate ligament. Anatomical and biomechanical considerations. J Bone Joint Surg (Am). 1990;72-B:259-67.
-
27Hefzy MS, Grood ES, Noyes FR. Factors affecting the region of most isometric femoral attachments. Part II: The anterior cruciate ligament. Am J Sports Med. 1989;17:208-16.
-
28Melhorn MJ, Henning CE. The relationship of the femoral attachment site to the isometric tracking of the anterior cruciate ligament graft. Am J Sports Med. 1987;15:539-42.
-
29Zavras TD, Race A, Bull AM, Amis AA. A comparative study of ‘isometric’ points for anterior cruciate ligament graft attachment. Knee Surg Sports Traumatol Arthrosc. 2001;9:28-33.
-
30Howell SM, Clark JA. Tibial tunnel placement in anterior cruciate ligament reconstruction and graft impingement. Clin Orthop Rel Res. 1992;283:187-95.
-
31Clancy W, Nelson D, Reider B, Narechania RG. Anterior cruciate ligament reconstruction using one-third patellar ligament, augmented by extra-articular tendon transfers. J Bone Joint Surg (Am). 1986;64:352-9.
-
32Freedman KB, D’Amato MJ, Nedeff DD, Kaz A, Bach BR Jr. Arthroscopic anterior ligament reconstruction: a metaanalysis comparing patellar tendon and hamstring tendon autografts. Am J Sports Med. 2003;31:2-11.
-
33Hogervorst T, Pels Rijcken TH, Rucker D, van der Hart CP, Taconis WK. Changes in bone scans after anterior cruciate ligament reconstruction: a prospective study. Am J Sports Med. 2002;30:823-33.
-
34McDermott ID, Amis AA. The consequences of meniscectomy. J Bone Joint Surg (Br). 2006;88-B:1549-56.
-
35Jonsson H, Riklund-Ahlström K, Lind J. Positive pivot shift after ACL reconstruction predicts later osteoarthrosis: 63 patients followed 5-9 years after surgery. Acta Orthop Scand. 2004;75:594-9.
-
36Loh JC, Fukuda Y, Tsuda E, Steadman RJ, Fu FH, Woo SLY. Knee stability and graft function following anterior cruciata ligament reconstruction: comparison between 22 o’clock and 10 o’clock femoral tunnel placement. Arthroscopy. 2003;3:297-304.
-
37Scopp JM, Jasper LE, Belkoff SM, Moorman CT. The effect of oblique femoral tunnel placement on rotational constraint of the knee reconstructed using patellar tendon autografts. Arthroscopy. 2004;20:294-9.
-
38Amis AA. The functions of the fibre bundles of the anterior cruciate ligament in anterior drawer, rotational laxity and the pivot shift. Knee Surg Sports Traumatol Arthrosc. 2012;20:613-20
-
39Kawaguchi Y, Kondo E, Takeda R, Akita K, Yasuda K, Amis AA. The role of fibers in the femoral attachment of the anterior cruciate ligament in resisting tibial displacement. Arthroscopy. 2015;31:435-44.
-
40Basdekis G, Abisafi C, Christel P. Influence of knee flexion angle on femoral tunnel characteristics when drilled through the anteromedial portal during anterior cruciate ligament reconstruction. Arthroscopy. 2008;24:459-64.
-
41Scopp JM, Jasper LE, Belkoff SM, Moorman CT III. The effect of oblique femoral tunnel placement on rotational constraint of the knee reconstructed using patellar tendon autografts. Arthroscopy. 2004;20:294-9.
-
42Jepsen CF, Lundberg-Jensen AK, Faunoe P. Does the position of the femoral tunnel affect the laxity or clinical outcome of the anterior cruciate ligament-reconstructed knee? A clinical, prospective, randomized, double-blind study. Arthroscopy. 2007;23:1326-33.
-
43Driscoll MD, Isabell GP Jr, Conditt MA, Ismaily SK, Jupiter DC, Noble PC, Lowe WR. Comparison of 2 femoral tunnel locations in anatomic single-bundle anterior cruciate ligament reconstruction: a biomechanical study. Arthroscopy. 2012;28:1481-9.
-
44Rahr-Wagner L, Thillemann TM, Pedersen AB, Lind MC. Increased risk of revision after anteromedial compared with transtibial drilling of the femoral tunnel during primary anterior cruciate ligament reconstruction: results from the Danish Knee Ligament Reconstruction Register. Arthroscopy. 2013;29:98-105.
-
45Smith JO, Yasen S, Risebury MJ, Wilson AJ. Femoral and tibial tunnel positioning on graft isometry in anterior cruciate ligament reconstruction: a cadaveric study. J Orthop Surg (Hong Kong). 2014;22:318-24.
-
46Tsai AG, Wijdicks CA, Walsh MP, Laprade RF. Comparative kinematic evaluation of all-inside single-bundle and double-bundle anterior cruciate ligament reconstruction: a biomechanical study. Am J Sports Med. 2010;38:263-72.
-
47Mediavilla I, Margalet E, Martín C. Resultados quirúrgicos de la reconstrucción del LCA mediante técnica de doble fascículo. Cuadernos de Artroscopia. 2011;8.
-
48Drews BH, Seitz AM, Huth J, Bauer G, Ignatius A, Dürselen L. ACL double-bundle reconstruction with one tibial tunnel provides equal stability compared to two tibial tunnels. Knee Surg Sports Traumatol Arthrosc. 2017;25:1646-52.
-
49Chalmers PN, Mall NA, Moric M, Sherman SL, Paletta GP, Cole BJ, Bach BR Jr. Does ACL reconstruction alter natural history? A systematic literature review of long-term outcomes. J Bone Joint Surg (Am). 2014;96-A:292-300.
-
50Tiamklang T, Sumanont S, Foocharoen T, Laopaiboon M. Double-bundle versus single-bundle reconstruction for anterior cruciate ligament rupture in adults. Cochrane Database Syst Rev. 2012;11:CD008413.
-
51Van Eck CF, Kopf S, Irrgang JJ, Blankevoort L, Bhandari M, Fu FH, Poolman RW. Single-bundle versus double-bundle reconstruction for anterior cruciate ligament rupture: a meta-analysis--does anatomy matter? Arthroscopy. 2012;28:405-24.
-
52Li YL, Ning GZ, Wu Q, Wu QL, Li Y, Hao Y, et al. Single-bundle or double-bundle for anterior cruciate ligament reconstruction: a meta-analysis. Knee. 2014;21:28-37.
-
53Mascarenhas R, Cvetanovich GL, Sayegh ET, Verma NN, Cole BJ, Bush-Joseph C, et al. Does double- bundle anterior cruciate ligament reconstruction improve postoperative knee stability compared with single-bundle techniques? A systematic review of overlapping meta-analyses. Arthroscopy. 2015;31:1185-96.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Afrontando con ilusión la tercera etapa de nuestra revista
- Primeras fases del desarrollo de un modelo experimental para el estudio de la reparación de las roturas del manguito rotador
- Deporte recreativo y choque femoroacetabular. ¿Qué se puede esperar después de la artroscopia de cadera?
- Conceptos biomecánicos de la cirugía reconstructiva del ligamento cruzado anterior
- Luxación de rodilla ante traumatismo de bajo impacto. A propósito de un caso
- Condromatosis sinovial: una causa poco frecuente de omalgia. Revisión de la literatura a propósito de un caso
- Sutura de lesión de la rampa posterior del menisco interno por portal posteromedial
- Instrucciones para el envío de fotografías para la cubierta de REACA
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista Española de Artroscopia y Cirugía Articular está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.