Transferencia endoscópica del flexor hallucis longus en el tratamiento de las roturas inveteradas del tendón calcáneo
Endoscopic flexor hallucis longus transfer for chronic calcaneus tendon rupture
Resumen:
Introducción: se consideran roturas crónicas del tendón calcáneo (TC) aquellas de más de 6 semanas de evolución. Según el tamaño del defecto, existen varias técnicas quirúrgicas, donde la transferencia tendinosa estaría indicada en defectos mayores de 5-6 cm.
El objetivo de este trabajo es presentar una técnica quirúrgica mínimamente invasiva, para el tratamiento de roturas crónicas inveteradas del TC, en pacientes con baja demanda funcional o importante comorbilidad asociada, mediante la transferencia endoscópica del flexor hallucis longus (FHL).
Material y métodos: presentamos una serie de 9 casos, 4 varones y 5 mujeres, con una edad media de 71 años (rango: 59-81 años), intervenidos entre enero de 2015 y enero de 2017, todos ellos por el mismo cirujano, con un seguimiento medio de 22 meses (rango: 14-31 meses), diagnosticados de rotura crónica degenerativa del tendón calcáneo.
A todos los pacientes se les realizó una resonancia magnética (RM), donde se evidenció un defecto medio de 75 mm (rango: 65-85 mm), por lo que optamos en todos ellos por la realización de una transferencia endoscópica del FHL. El tiempo medio desde la rotura del tendón calcáneo hasta la cirugía fue de 36 semanas (rango: 20-72 semanas).
Resultados: la escala de la American Orthopaedic Foot and Ankle Society (AOFAS) media prequirúrgica fue de 35 puntos (rango: 26-56), pasando a un valor medio posquirúrgico de 87 puntos (rango: 74-94), siendo esta diferencia estadísticamente significativa (p = 0,01).
Ninguno de los pacientes ha presentado ninguna complicación, con un excelente resultado clínico-funcional.
Conclusiones: la transferencia endoscópica del FHL es una adecuada alternativa al tratamiento quirúrgico de las roturas crónicas inveteradas del TC en pacientes seleccionados frente a las técnicas de cirugía a cielo abierto, ofreciendo unos excelentes resultados clínico-funcionales.
Abstract:
Background: chronic calcaneus tendon ruptures are considered those that are more than 6 weeks old. Depending on the size of the defect, numerous techniques have been described, where the tendon transfer would be indicated in defects greater than 5-6 cm.
The aim of this study is to present a minimally invasive surgical technique, with excellent functional results, for the treatment of chronic calcaneal tendon ruptured, in patients with low functional demand or important associated comorbidity, through the endoscopic transfer of flexor hallucis longus (FHL).
Methods: we present a series of 9 cases, 4 men and 5 women, with an average age of 71 years (range: 59-81 years), intervened between January 2015 and January 2017 at the University Hospital 12 de Octubre in Madrid, all of them by the same surgeon, with a mean follow-up of 22 months (range: 14-31 months), diagnosed all of them with chronic degenerative rupture of the calcaneal tendon. Preoperative magnetic resonance imaging (MRI) was obtained, where an average defect of 75 mm (range: 65-85 mm) was evidenced, so we opted for an endoscopic transfer of the FHL in all of them. The mean time from the rupture of the calcaneal tendon to surgery was 36 weeks (range: 20-72 weeks).
Results: the mean American Orthopedic Foot and Ankle Society (AOFAS) score increased from 35 preoperatively (range: 26-56) to 87 (range: 74-94), and this difference being statistically significant (p = 0.01).
None of the patients presented any complication, with an excellent clinical-functional result.
Conclusions: in our series, the endoscopic transfer of FHL is an adequate alternative to the surgical treatment of chronic calcaneus tendon ruptured in selected patients compared to open surgery techniques.
This technique makes it possible to avoid skin problems and long periods of inactivity, offering excellent clinical-functional results in patients with low functional demand and high comorbidity (disorders of peripheral circulation, diabetes mellitus, poor condition of soft tissues, etc.).
Introducción
El tendón calcáneo (TC) es el tendón más largo, grueso y potente del sistema musculoesquelético. A pesar de ello, no es infrecuente su rotura debido a la existencia de una zona central hipovascular, a unos 3-6 cm de su inserción en el calcáneo, que debido a microtraumatismos de repetición produce su degeneración y rotura(1,2).
Se define rotura crónica del TC como aquella en la que han pasado de 4 a 6 semanas desde la lesión(3), presentadas generalmente como resultado de un diagnóstico erróneo o una ruptura aguda no diagnosticada, donde la incidencia varía según la bibliografía consultada.
Clásicamente, se da en pacientes mayores de 50 años, pacientes en tratamiento con corticoides, con quinolonas o en pacientes con enfermedades reumáticas.
En estas ocasiones, nos encontraremos unos extremos tendinosos retraídos y degenerados, siendo su tratamiento un desafío para el cirujano de pie y tobillo.
El objetivo de la cirugía es restaurar la función del TC y, en función del tamaño del defecto del tendón, existen varias técnicas abiertas descritas. La clasificación de Myerson(4) las divide en 3 grados en función del tamaño del defecto: grado 1 para defectos de 1-2 cm (reparación término-terminal), grado 2 para defectos de 2-5 cm (reparación con el alargamiento mediante la técnica V-Y(5), asociado o no a transferencia tendinosa) y grado 3 para defectos mayores de 5 cm (reparados mediante la transferencia tendinosa aislada o en asociación con alargamiento V-Y o trasplante masivo osteotendinoso con aloinjerto(6), autoinjertos –fascia lata, gracilis(7)– o injertos sintéticos(8,9,10)).
Dentro de las transferencias tendinosas, los tendones más utilizados son el peroneo brevis(11), el flexor hallucis longus (FHL)(12,13) y el flexor digitorum longus (FDL)(14).
Las técnicas abiertas requieren incisiones amplias, que conllevan el riesgo de infección y dehiscencia de la herida quirúrgica. Para minimizar estas complicaciones, se han desarrollado en los últimos años diferentes técnicas mínimamente invasivas o endoscópicas.
El objetivo de este trabajo es presentar los resultados clínico-funcionales de una técnica quirúrgica mínimamente invasiva, para el tratamiento de las roturas crónicas del TC en pacientes con baja demanda funcional o importante comorbilidad asociada, mediante la transferencia endoscópica del FHL.
Material y métodos
Entre enero de 2015 y enero de 2017, 9 pacientes diagnosticados de ruptura crónica del TC fueron tratados endoscópicamente mediante la transferencia tendinosa del FHL tras la obtención de un consentimiento informado. La muestra estaba compuesta por 4 hombres y 5 mujeres, con una edad media de 71 años (rango: 59-81 años). En cuanto a la lateralidad, el tobillo derecho estaba afectado en 5 casos y el tobillo izquierdo en 4 casos.
Como antecedentes personales de interés destaca que 4 pacientes presentaban diabetes mellitus de tipo II (3 pacientes controlados con antidiabéticos orales y 1 paciente insulino-dependiente con macro- y microangiopatía evolucionada), 3 pacientes eran fumadores activos crónicos, 1 paciente presentaba una hepatopatía de larga evolución y 1 paciente con insuficiencia venosa crónica (Tabla 1).
El seguimiento medio de los pacientes fue de 22 meses (rango: 14-31 meses).
Las indicaciones quirúrgicas serían aquellos pacientes de edad avanzada, con alto riesgo anestésico y con comorbilidades asociadas, tales como trastornos vasculares o lesiones cutáneas, en las que las cirugías clásicas a cielo abierto podrían comprometer las partes blandas, con el consiguiente riesgo de infección o dehiscencia de la herida quirúrgica (Tabla 2).
Los criterios de inclusión incluyeron la ruptura crónica del TC (mínimo de 4 semanas desde la ruptura), con un seguimiento mínimo de 12 meses. Como criterios de exclusión se establecieron: antecedentes de cirugía previa de pie y tobillo, y la existencia de artropatía en las articulaciones tibiotalar y subtalar. La presencia de la patología del tendón FHL también fue un criterio de exclusión. El tamaño del defecto del TC no fue un criterio de exclusión.
La escala funcional utilizada fue la escala de la American Orthopaedic Foot and Ankle Society (AOFAS)(15) y se evaluaron antes de la cirugía y en el último seguimiento (mínimo de 1 año después del procedimiento). También se evaluó clínicamente la posible disminución o pérdida de fuerza de flexión plantar del hallux tras la transferencia del mismo.
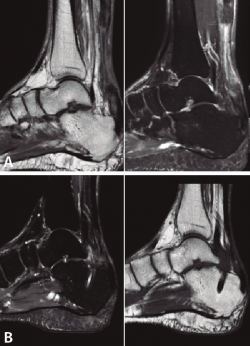
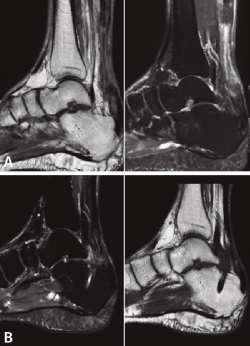
A todos los pacientes se les realizó una radiografía simple, sin detectar ninguna lesión ósea, y una resonancia magnética (RM) preoperatoria para demostrar la existencia de una rotura completa del TC, poder medir el defecto existente y evaluar el estado del FHL previo a la transferencia, y las posibles variantes anatómicas que puedan facilitar o dificultar la técnica quirúrgica descrita. Finalmente, se realizó una RM postoperatoria a todos los pacientes, a los 9-12 meses después de la cirugía, para ver la correcta integración del FHL en el calcáneo y la posible reparación del TC.
Técnica artroscópica
El paciente es colocado en decúbito prono bajo anestesia espinal o general, con un torniquete en la raíz del muslo. Se coloca un saquete en la espina iliaca contralateral para evitar la varización del retropié.
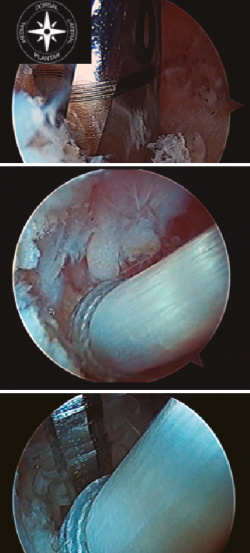
Se realizan los portales artroscópicos posteriores clásicos descritos por Van Dijk en el año 2000 (posteromedial y posterolateral)(16). El portal posterolateral se utiliza como portal de visión y el portal posteromedial como el portal de trabajo. Inicialmente, debemos proceder al desbridamiento de la superficie posterior del calcáneo y anterior del tendón de Aquiles cerca de su área de inserción. Una vez identificado el FHL, debemos tener en cuenta que el paquete neurovascular tibial se encuentra medial a él; por tanto, se debe extremar la precaución cuando se manipula el tendón del FHL.
La zona 1 del FHL es de nuestro interés para este trabajo y es de la que nos ocuparemos a continuación. En la misma, el FHL discurre entre el maléolo medial y el astrágalo, en un túnel osteofibroso que contiene el pedículo neurovascular, el tendón tibial posterior y los tendones flexores de los dedos.
Las variantes anatómicas, como el vientre muscular bajo del FHL o el tendón accesorio del FHL, hacen que la distancia del FHL al paquete neurovascular sea mayor.
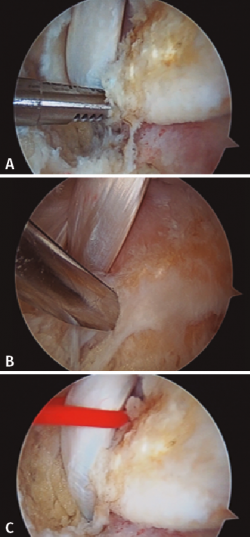
Una vez identificado el FHL, es importante realizar un correcto desbridamiento del túnel osteofibroso por donde discurre, para así poder obtener la mayor cantidad posible del mismo. Recomendamos dar una sutura en el tendón FHL, o alternativamente usar una pinza artroscópica, para traccionar del mismo y así poder obtener tendón FHL incluso de zona 2 (Figura 1).
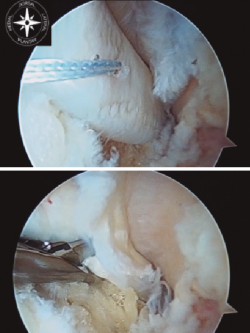
La longitud mínima ideal del tendón FHL para la transposición en el calcáneo es de 15 mm. Cuando se realiza el corte del FHL con la tijera artroscópica, se debe flexionar el tobillo y la primera metatarsofalángica para obtener la máxima longitud posible y a su vez proteger el paquete neurovascular (Figura 2).
Una vez seccionado el tendón, se saca a través del portal posteromedial y se realiza una sutura de refuerzo de tipo Krakow y medimos el tamaño de la plastia (Figura 3).
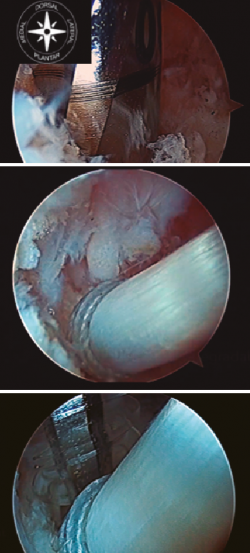
Posteriormente, debemos realizar el túnel ciego en el calcáneo. El lugar idóneo de inserción del FHL sería en una posición central y lo más posterior posible de la tuberosidad posterior del calcáneo, si bien es cierto que, en ocasiones, dependerá de la longitud obtenida de tendón del FHL. Para ello, se utiliza una aguja guía de Kirschner con un ojal para poder labrar el túnel en el calcáneo. La aguja de Kirschner se introduce en el calcáneo en una dirección dorsal-medial a plantar-lateral. El diámetro adecuado de la perforación depende del diámetro del tendón FHL medido. Generalmente será 0,5-1 mm mayor al tamaño de la plastia (Figura 4).
Como mínimo, se debe introducir de 10 a 15 mm de la plastia obtenida. Una vez realizado el túnel, se introduce una sutura en el ojal de la aguja de Kirschner y traccionamos de la aguja desde plantar para poder pasar las suturas a través del túnel labrado y así poder introducir el tendón en el interior del túnel. Posteriormente, con el tobillo en flexión plantar, se tracciona de las suturas para tensar el tendón del FHL bajo visión artroscópica directa, con el fin de obtener una tensión adecuada de la plastia, y se fija con un tornillo de biotenodesis del mismo tamaño o 1 mm más ancho que el túnel del calcáneo realizado (Figura 4).
Las incisiones cutáneas se suturan y se coloca una férula de yeso suropédica posterior con 15-20° de flexión plantar.
En cuanto al manejo postoperatorio, el paciente deberá permanecer en descarga con la férula unos 15-20 días, para posteriormente retirar los puntos de la herida quirúrgica y sustituir la férula de yeso por una ortesis articulada de tipo Walker (DonJoy, Surrey, United Kingdom) a 90°, permitiendo la carga parcial protegida durante 6-8 semanas. La rehabilitación se inicia a las 4 semanas con el fin de aumentar progresivamente la fuerza y el rango de movimiento de la articulación del tobillo.
Análisis estadístico
La estadística descriptiva incluyó medias, desviaciones estándar y frecuencias para datos categóricos. Los grupos de estudio fueron comparados usando el test de Wilcoxon para muestras pareadas.
Los resultados se presentarán con un 95% de intervalos de confianza y, por lo tanto, se considerará un valor p < 0,05 como estadísticamente significativo.
El análisis estadístico fue llevado a cabo con el software estadístico SPSS versión 22 para Windows.
Resultados
El tiempo medio de seguimiento fue de 22 meses (mediana: 22; rango: 14-31 meses), sin pérdida de pacientes durante el periodo de estudio. El tiempo medio desde la rotura del TC hasta la cirugía fue de 36 semanas (mediana: 33; rango: 20-72 semanas).
La RM preoperatoria mostró una rotura completa del TC y la retracción proximal del tendón en todos los casos, con un defecto medio de 75 mm (mediana: 76; rango: 65-85 mm). No se observó patología del tendón de FHL u otras anormalidades en ninguno de los pacientes.
El tendón de FHL se obtuvo en la zona 1 en todos los pacientes, con un diámetro medio de la plastia obtenida de 6 mm. La longitud del tendón fue suficiente para ser transferido al túnel del calcáneo sin dificultades en todos los casos. El túnel del calcáneo se labraba rutinariamente 1 mm más ancho que el diámetro medido del tendón y con una longitud de 25-30 mm, para así poder introducir unos 15 mm de longitud del tendón.
El tendón FHL se fijó con un tornillo de biotenodesis del mismo tamaño del túnel.
Posteriormente, a todos pacientes se les realizó una RM postoperatoria a los 9-12 meses, para observar la correcta integración de la plastia en el túnel del calcáneo. En todos los casos se objetivó la reparación del defecto del TC, lo cual lo atribuimos a la aposición del vientre muscular del FHL y a la carga en ausencia de estrés mecánico (Figura 5).
La puntuación media de la AOFAS aumentó de 35 puntos preoperatoria (mediana: 33; rango: 2-56 puntos) a 87 puntos postoperatoriamente (mediana: 88; rango: 74-94 puntos), siendo esto estadísticamente significativo (test de Wilcoxon para muestras pareadas; p < 0,01).
Todos los pacientes volvieron a sus actividades diarias previas a la lesión sin dificultades. Actualmente, presentan una fuerza de flexión plantar del tobillo similar a la contralateral. No se encontraron complicaciones neurovasculares o cutáneas.
No se observaron complicaciones debidas a la técnica artroscópica ni debidas a la obtención del tendón del FHL, sin observar pérdida de fuerza de flexión plantar del hallux.
Discusión
Las roturas crónicas de TC suponen un reto para el cirujano de pie y tobillo. Debemos tener en cuenta que actuamos sobre un tejido degenerado, con escaso potencial biológico para la reparación, con un tejido cicatricial con abundante colágeno de tipo III, lo cual explica la baja capacidad de resistencia a las fuerzas de tracción y la alta tasa de rerroturas, más aún en pacientes con elevada comorbilidad (fumadores crónicos, diabetes mellitus, insuficiencia venosa crónica, etc.), que favorece la degeneración tisular(17).
El objetivo del presente trabajo es mostrar las ventajas que ofrece la técnica artroscópica para la reparación de las roturas crónicas del TC, minimizando las posibles complicaciones presentes en las cirugías clásicas a cielo abierto descritas en la literatura, tales como la infección o dehiscencia de la herida quirúrgica(18), especialmente en pacientes mayores, pacientes con compromiso cutáneo y comorbilidades asociadas que aumenten el riesgo de estas, como diabetes mellitus o insuficiencia venosa periférica(19,20).
De todas las opciones de transferencia tendinosa, el tendón del FHL creemos que es el que más ventajas nos aporta, debido a que es un potente flexor plantar, que realiza la fuerza contráctil en el eje más próximo al TC, manteniendo el balance muscular del tobillo de la forma más fisiológica posible(21), con una escasa morbilidad para el paciente(22) y siendo de un acceso relativamente sencillo cuando se tiene experiencia en la cirugía endoscópica posterior de tobillo.
Por otra parte, trabajos como el de Hahn et al.(23) demuestran por medio de la RM la completa integración del tendón FHL en el 60% de los pacientes e hipertrofia del mismo en el 80% de los casos, o el 52% en el caso del trabajo de Oksanen et al.(24), lo cual indica la alta capacidad de adaptación del FHL cuando es transferido a un paciente con una lesión del sistema gastrosóleo.
A pesar de todas las ventajas mostradas por la técnica endoscópica, es importante prestar atención a los diferentes detalles que pueden complicar esta técnica quirúrgica derivados de la obtención del FHL, del correcto posicionamiento del túnel óseo en el calcáneo o de la elección adecuada del implante para la fijación del tendón.
La longitud mínima que debe introducirse de FHL en el túnel del calcáneo debe ser de 10-15 mm. Para ello, es importante tener en cuenta la zona donde se realizará la tenodesis del FHL. Existen 3 zonas del FHL: la zona 1 cuando el tendón discurre posterior al maléolo medial hasta el sustentaculum tali, la zona 2 desde el sustentaculum tali hasta el nudo de Henry y la zona 3 desde el nudo de Henry hasta su inserción en la falange distal. La obtención del tendón del FHL en el nudo de Henry, o proximal a él, permite obtener la longitud más larga posible; sin embargo, esta zona tiene el riesgo de lesión del nervio plantar medial y requiere de una incisión plantar adicional(25).
Otras zonas posibles para la obtención del tendón son en la zona 1, justo antes de que el tendón pase a través de su túnel osteofibroso, o en la zona 2, cuando el tendón pasa por debajo del sustentaculum tali. Ambas áreas permiten la longitud mínima necesaria de tendón del FHL para una correcta fijación en el calcáneo(26,27). En nuestra serie, en todos los casos obtuvimos una longitud suficiente de plastia obteniéndola en la zona 1.
Es importante conocer las relaciones anatómicas entre el FHL y las estructuras neurovasculares adyacentes y sus posibles variaciones anatómicas, con el fin de evitar su lesión durante la obtención del mismo. Si obtenemos el tendón en la zona 1, debemos conocer que la distancia media desde el tendón FHL al paquete neurovascular tibial es aproximadamente de 0,9 mm(28). Si, por el contrario, lo obtenemos en la zona 2, debemos saber que la rama calcánea medial del nervio tibial está aproximadamente a 1,3 mm del tendón del FHL y la rama nerviosa para el músculo abductor digiti quinti a 1,4 mm(29). Por tanto, a la hora de obtener el tendón del FHL mediante los portales endoscópicos posteriores, tanto en la zona 1 como en la zona 2 existe el riesgo de lesión del paquete neurovascular, si bien los portales endoscópicos posteriores son seguros y reproducibles cuando se realiza la técnica de manera protocolizada(30).
La presencia de ciertas variantes anatómicas del tendón FHL, como es el vientre muscular bajo o FDL accesorio, aumenta la distancia entre el FHL y el paquete neurovascular y, por lo tanto, disminuye el riesgo de lesión vasculonerviosa(28).
En nuestro estudio, fue especialmente relevante la mejoría de la puntuación media de la escala AOFAS, la cual aumentó de 35 antes de la operación a 87 puntos postoperatoriamente de media. Todos los pacientes volvieron a sus actividades previas a la lesión, sin presentar limitaciones ni complicaciones derivadas de la técnica quirúrgica. A su vez, es también relevante el fenómeno de reparación del TC que se pudo observar en todos los pacientes en la RM postoperatoria. Este fenómeno se cree que se debe al aporte vascular que supone aproximar el vientre muscular del FHL al realizar la transferencia tendinosa, junto con la carga en ausencia de estrés mecánico.
Clásicamente, se decía que la transferencia del FHL podría provocar una pérdida de fuerza de flexión plantar del hallux; sin embargo, en nuestra serie, al igual que en otros trabajos de la literatura, dicho fenómeno no parece ser clínicamente relevante(27,31,32) y no fue observado en ninguno de nuestros pacientes.
Nuestro trabajo presenta como debilidades la ausencia de un grupo control de pacientes tratados de forma conservadora, con cirugía abierta o con transferencia de otro injerto tendinoso. Por otra parte, tenemos pequeño tamaño muestral, si bien es cierto que, teniendo en cuenta la baja incidencia de diagnóstico de roturas crónicas inveteradas y las indicaciones quirúrgicas tan restrictivas en nuestro trabajo y en comparación con otros trabajos publicados con tamaños muestrales similares al nuestro o no mucho mayores(32), pensamos que es de un tamaño muestral suficiente para presentar dicha técnica quirúrgica y conocer los resultados obtenidos.
Conclusión
La transferencia endoscópica del FHL pensamos que es una adecuada alternativa quirúrgica en el tratamiento de las roturas crónicas inveteradas del TC, permitiendo obviar los problemas cutáneos y los largos periodos de inactividad, ofreciendo unos buenos resultados clínico-funcionales en pacientes seleccionados, de baja demanda funcional y elevada comorbilidad (trastornos de la circulación periférica, diabetes mellitus, mal estado de partes blandas, etc.).
Tablas
Tabla 2. Indicaciones quirúrgicas para realizar la transferencia tendinosa del flexor hallucis longus en las roturas inveteradas del tendón calcáneo
Figuras
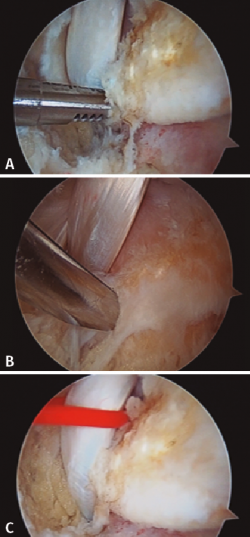
Figura 1. Identificación, desbridamiento y tracción con vessel loop del tendón flexor hallucis longus (FHL). A: FHL; B: astrágalo; C: calcáneo.
Figura 2. Tracción del tendón flexor hallucis longus (FHL) y sección del mismo en la zona 2, con flexión de la primera metatarsofalángica y tobillo.
Figura 3. Obtenemos la plastia por el portal posteromedial, se realiza sutura de refuerzo de tipo Krackow y medición de la plastia.
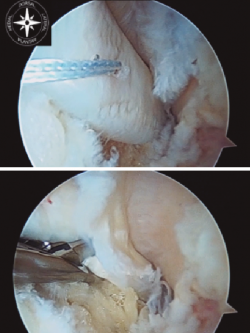
Figura 4. Túnel ciego en la tuberosidad posterior del calcáneo. Introducción de la plastia y fijación con tornillo de biotenodesis.
Información del artículo
Cita bibliográfica
Autores
Jorge Ferrero Recaséns
Unidad de Pie y Tobillo. Hospital Universitario 12 de Octubre. Madrid
Premio Antonio Viladot otorgado durante el 40 Congreso SEMCPT, celebrado en Sevilla del 14 al 16 de junio de 2018.
María Ángela Mellado Romero
Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario 12 de Octubre. Madrid
Elena Vacas Sánchez
Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario 12 de Octubre. Madrid
Complejo Hospitalario Quirónsalud Ruber Juan Bravo. Madrid
Enrique Javier Sánchez Morata
Unidad de Pie y Tobillo. Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario 12 de Octubre. Madrid
Jesús Vilá y Rico
Servicio de Cirugía Ortopédica y Traumatología. Hospital Universitario 12 de Octubre. Madrid
Departamento de Cirugía. Universidad Complutense de Madrid. Madrid
Complejo Hospitalario Quirón Ruber. Madrid
Presidente saliente de la Revista del Pie y Tobillo
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de intereses. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Sanz-Hospital FJ, Martin CM, Escalera J, Llanos LF. Achilles-calcaneal vascular network. Foot Ankle Int. 1997;18:506-9.
-
2Kvist M, Józsa L, Järvinen M. Vascular changes in the ruptured Achilles tendon and paratendon. Inter Orthop. 1992;16(4):377-82.
-
3Gabel S, Manoli A 2nd. Neglected rupture of the Achilles tendon. Foot Ankle Int. 1994;15:512-7.
-
4Myerson MS. Achilles tendon ruptures. Instr Course Lect. 1999;48:219-30.
-
5Abraham E, Pankovich AM. Neglected rupture of the Achilles tendon. Treatment by V-Y tendinous flap. J Bone Joint Surg Am. 1975;57:253-5.
-
6Nellas ZJ, Loder BG, Wertheimer SJ. Reconstruction of an Achilles tendon defect utilizing an Achilles tendon allograft. J Foot Ankle Surg. 1996;35:144-8.
-
7Maffulli N, Leadbetter WB. Free gracilis tendon graft in neglected tears of the Achilles tendon. Clin J Sport Med. 2005;15:56-61.
-
8Amis AA, Campbell JR, Kempson SA, Miller JH. Comparison of the structure of neotendons induced by implantation of carbon or polyester fibres. J Bone Joint Surg Br. 1984;66:131-9.
-
9Ozaki J, Fujiki J, Sugimoto K, Tamai S, Masuhara K. Reconstruction of neglected Achilles tendon rupture with Marlex mesh. Clin Orthop Relat Res. 1989;238:204-8.
-
10Parsons JR, Weiss AB, Schenk RS, Alexander H, Pavlisko F. Long-term followup of Achilles tendon repair with an absorbable polymer carbon fiber composite. Foot Ankle. 1989;9:179-84.
-
11Pérez Teuffer A. Traumatic rupture of the Achilles tendon. Reconstruction by transplant and graft using the lateral peroneus brevis. Orthop Clin North Am. 1974;5:89-93.
-
12Hahn F, Meyer P, Maiwald C, Zanetti M, Vienne P. Treatment of chronic Achilles tendinopathy and ruptures with flexor hallucis tendon transfer: clinical outcome and MRI findings. Foot Ankle Int. 2008;29:794-802.
-
13Wegrzyn J, Luciani JF, Philippot R, Brunet-Guedj E, Moyen B, Besse JL. Chronic Achilles tendon rupture reconstruction using a modified flexor hallucis longus transfer. Int Orthop. 2010;34:1187-92.
-
14Maffulli N, Oliva F, Maffulli GD, Buono AD, Gougoulias N. Surgical management of chronic Achilles tendon ruptures using less invasive techniques. Foot Ankle Surg. 2018 Apr;24(2):164-70.
-
15Kitaoka HB, Alexander IJ, Adelaar RS, Nunley JA, Myerson MS, Sanders M. Clinical rating systems for the ankle-hindfoot, midfoot, hallux, and lesser toes. Foot Ankle Int. 1994;15:349-53.
-
16Van Dijk CN, Scholten PE, Krips R. A 2-Portal Endoscopic Approach for Diagnosis and Treatment of Posterior Ankle Pathology. Arthroscopy. 2000;16(8):871-6.
-
17Ronga M, Karousou E, Vigetti D, Passi A, Maffulli N. Gene expression and protein analysis in ruptured human Achilles tendons. Arthroscopy. 2011;28:e490-e491.
-
18Bruggeman NB, Turner NS, Dahm DL, Voll AE, Hoskin TL, Jacofsky DJ, Haidukewych GJ. Wound complications after open Achilles tendon repair: an analysis of risk factors. Clin Orthop Relat Res. 2004;427:63-6.
-
19Gossage W, Kohls-Gatzoulis J, Solan M. Endoscopic assisted repair of chronic Achilles tendon rupture with flexor hallucis longus augmentation. Foot Ankle Int. 2010;31(4):343-7.
-
20Lui TH, Chan WC, Maffulli N. Endoscopic flexor hallucis longus tendon transfer for chronic Achilles tendon rupture. Sports Med Arthrosc. 2016;24:38-41.
-
21Wegrzyn J, Luciani JF, Philippot R, Brunet-Guedj E, Moyen B, Besse JL. Chronic Achilles tendon rupture reconstruction using a modified flexor hallucis longus transfer. Int Orthop 2010;34:1187-92.
-
22Coull R, Flavin R, Stephens MM. Flexor hallucis longus tendon transfer: evaluation of postoperative morbidity. Foot Ankle Int. 2003;24:931-4.
-
23Hahn F, Meyer P, Maiwald C, Zanetti M, Vienne P. Treatment of chronic Achilles tendinopathy and ruptures with flexor hallucis tendon transfer: clinical outcome and MRI findings. Foot Ankle Int. 2008;29:794-802.
-
24Oksanen MM, Haapasalo HH, Elo PP, Laine HJ. Hypertrophy of the flexor hallucis longus muscle after tendon transfer in patients with chronic Achilles tendon rupture. Foot Ankle Surg. 2014 Dec;20(4):253-7.
-
25Herbst SA, Miller SD. Transection of the medial plantar nerve and hallux cock-up deformity after flexor hallucis longus tendon transfer for Achilles tendinitis: case report. Foot Ankle. 2006;27(8):639-41.
-
26Mao H, Shi Z, Keith L, Dong W, Yin W, Xu D. Anatomical study for flexor hallucis longus tendon transfer in treatment of Achilles tendinopathy. Surg Radiol Anat. 2015 37:639-47.
-
27Lui TH. Endoscopic-assisted flexor hallucis longus transfer: harvest of the tendon at zone 2 or zone 3. Arthrosc Tech. 2015;4(6):e811-e814.
-
28Vega J, Redó D, Savín G, Malagelada F, Dalmau M. Anatomical variations of flexor hallucis longus tendon increase safety in hindfoot endoscopy. Knee Surg Sports Traumatol Arthrosc. 2017;25(6):1929-35.
-
29Keeling JJ, Guyton GP. Endoscopic flexor hallucis longus decompression: a cadaver study. Foot Ankle Int. 2007;28:810-4.
-
30Vilá J, Vega J, Mellado M, Ramazzini R, Golano P. Hindfoot endoscopy for the treatment of posterior ankle impingement syndrome: a safe and reproducible technique. Foot Ankle Surg. 2014;20(3):174e179.
-
31Martin RL, Manning CM, Carcia CR, Conti SF. An outcome study of chronic Achilles tendinosis after excision of the Achilles tendon and flexor hallucis longus tendon transfer. Foot Ankle Int. 2005;26:691-7.
-
32Vega J, Vilá J, Batista J, Malagelada F, Dalmau-Pastor M. Endoscopic Flexor Hallucis Longus Transfer for Chronic Noninsertional Achilles Tendon Rupture. Foot Ankle Int. 2018;39(12):1464-72.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Seguimos avanzando
- Protocolos de actuación en infecciones sobre osteosíntesis en cirugía de pie y tobillo
- Tratamiento de la rotura del complejo lateral externo del tobillo mediante artroscopia anterior y Broström- Gould abierto en pacientes deportistas de alto nivel
- Fascitis plantar recalcitrante: ¿fasciotomía parcial o liberación de gemelo medial? Resultados preliminares a 6 meses
- Transferencia endoscópica del flexor <em>hallucis longus</em> en el tratamiento de las roturas inveteradas del tendón calcáneo
- Artrodesis con espaciadores de tantalio en fracaso de prótesis de tobillo
- Resultados de la cirugía de liberación proximal de gemelo medial en el tratamiento de la tendinopatía insercional de Aquiles
- Tratamiento conservador de la enfermedad de Müller-Weiss. A propósito de un caso
- Método de aumentación en reparación de inestabilidad lateral crónica de tobillo: consejo técnico
- Comentario a “Método de aumentación en reparación de inestabilidad lateral crónica de tobillo: consejo técnico”
- Revista de revistas
Más en PUBMED
Más en Google Scholar
Más en ORCID


Revista del pie y tobillo está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.