Schwannoma, una extraña causa de síndrome del túnel del tarso
Schwannoma, a rare cause of tarsal tunnel syndrome
Resumen:
El schwannoma es el tumor benigno de nervio periférico más frecuente, siendo excepcional su presencia en los nervios de miembros inferiores, con una tasa de prevalencia del 1 al 10%. En este trabajo discutimos y revisamos el schwannoma del nervio periférico al nivel del nervio tibial posterior en su paso por el túnel tarsiano, describimos los hallazgos clínicos y de imagen, y las estrategias terapéuticas para tratar y diagnosticar esta tumoración. Nosotros nos basamos en la presentación de un caso clínico de una paciente de 85 años, diagnosticada de schwannoma benigno en el nervio tibial posterior, que fue sometida a cirugía de enucleación con resultado excelente y desaparición de la sintomatología de síndrome del túnel tarsiano que esta tumoración le provocaba.
Abstract:
Schwannoma is the most common benign peripheral nerve tumour, its presence in lower limb nerves being exceptional, with a prevalence rate of 1 to 10%. In this paper we discuss and review schwannoma of the peripheral nerve at the level of the posterior tibial nerve passing through the tarsal tunnel, describe clinical and imaging findings and therapeutic strategies to treat and diagnose this tumour. We base ourselves on the presentation of a clinical case of an 85-year-old patient diagnosed with benign schwannoma in the posterior tibial nerve who underwent enucleation surgery with excellent results and disappearance of the symptoms of tarsal tunnel syndrome caused by this tumour.
Introducción
El túnel del tarso es la encrucijada anatómica por la que el nervio tibial posterior (NTP) accede a la planta del pie para dividirse en sus 2 ramas terminales: los nervios plantar interno y externo. El techo de este desfiladero está formado por un espesamiento de la fascia profunda de la pierna que se concreta en el retináculo de los flexores formando el ligamento anular, extendido hacia atrás por estructuras óseas inextensibles, como son el borde posterior del maléolo interno, la cara posterior del astrágalo y la cara interna del calcáneo. El NTP penetra en este túnel y lo atraviesa, colocándose sobre las vainas de los tendones de los músculos tibial posterior, flexor del dedo gordo y flexor largo de los dedos, en la vecindad de la arteria tibial posterior y sus venas satélites. Dentro del túnel y a distancia variable, el NTP se divide en sus 2 ramas terminales, los nervios plantar interno o medial y externo o lateral, emitiendo de su rama lateral una rama sensitiva y motora para el talón, conocida como el nervio de Baxter(1).
Atendiendo a la descripción clásica de Kopell y Thompson en 1960(2), este síndrome se debe a la compresión del nervio tibial y sus ramas a su paso por el territorio retrosubmaleolar interno. Sin embargo, fue en 1962 cuando Keck y Lam consideraron el síndrome del túnel tarsiano (STT) tradicional como “síndrome del túnel tarsiano proximal”, en el que existe atrapamiento del NTP, definiendo el atrapamiento de las ramas terminales del nervio como “síndrome del túnel tarsiano distal”(3).
La sintomatología clínica ha sido bien descrita y se caracteriza por dolor en el maléolo interno con hipoestesia y parestesias irradiadas a la planta del pie, extendidas hasta los dedos y alguna vez hacia el talón(4,5). Los síntomas empeoran con la bipedestación y con la marcha, y eventualmente por la noche, mejorando con el reposo del pie en elevación(6).
La etiología del STT que produce la compresión de estas ramas nerviosas periféricas puede ser clasificada en 2 grupos, bien sea por compresión extrínseca (hipertrofia del ligamento anular, varicosidades de la red venosa de Lazhorte, desviaciones de varo o valgo del retropié, fragmentos de fractura, gangliones, traumatismos directos y espolones artríticos) o bien por compresión intrínseca (lipomas intratúnel, varicosidades intratúnel, tumores neurales y de células gigantes, perineurofibrosis y tenosinovitis de los tendones adyacentes)(6,7). Una de las causas mas extrañas de STT que existen son los tumores neuronales de la vaina de los nervios periféricos (TNVNP), como el caso de la paciente de 85 años que presentamos, siendo esto fruto de nuestro estudio.
Los TNVNP representan el 10,2% de todos los tumores de pie y tobillo, y dentro de estos los podemos dividir en el schwannoma (57%), el neurofibroma (29%) y los tumores malignos de los nervios periféricos (14%)(8). Debemos tener en cuenta que, cuando realizamos una búsqueda bibliográfica del schwannoma, lo podemos encontrar con términos como neurilemoma, neurocitoma, glioma periférico o fibroblastoma perineural(9), aunque hoy en día los términos aceptados con mas frecuencia son los 2 primeros(10).
Los schwannomas son neoplasias benignas, no invasivas y encapsuladas, con frecuencia solitarias, que surgen de las células de Schwann que conforman la vaina de mielina de los nervios periféricos(11). Existen informes de schwannomas múltiples dentro del mismo nervio y estos casos requieren una evaluación de neurofibromatosis(12,13). Aunque se encuentran en cualquier nervio, presentan predilección por la cabeza, el cuello y el plexo braquial. En la extremidad inferior son menos frecuentes pero, cuando se localizan en ella, es el NTP el que suele estar afectado(14). Una serie de revisiones retrospectiva recoge que solo 14 de 137 TNVNP están localizados en el pie o el tobillo(15). En otras series solo 12 de 104 TNVNP son localizados en esta parte anatómica(16).
Debido a la lenta tasa de crecimiento de estos tumores, un diagnóstico de STT puede confundirse o retrasarse, lo que resulta en un periodo prolongado de administración de analgesia sin mejoría y en el deterioro de las actividades diarias(17,18). Este lento crecimiento presenta un aspecto bueno y es que, al existir menos mitogénesis, existe menos riesgo de degeneración maligna, encontrándose menos del 1% de schwannomas malignos, más conocidos como neurofibrosarcomas(19).
La cirugía es una solución indicada para el problema de este tipo de pacientes, con resolución de la clínica en la mayoría de los casos. Nosotros presentamos el caso clínico de un schwannoma benigno en la extremidad inferior, que incluía dolor, parestesias, debilidad y una masa palpable, llegando a producir un STT.
Objetivo
Nuestro objetivo es, a raíz del caso clínico que presentamos, discutir y revisar la bibliografía del schwannoma del nervio periférico, describir los hallazgos clínicos, de imagen, así como las estrategias terapéuticas, para ayudar a tratar y diagnosticar el schwannoma del nervio periférico en pacientes con clínica de STT.
Método
Para ello, se llevó a cabo una revisión bibliográfica avanzada, con evaluación y discusión de las últimas evidencias publicadas y de sus aplicaciones prácticas en este tipo de pacientes.
Caso clínico
Anamnesis
A nuestra consulta llegó una paciente mujer, de 85 años, que como antecedentes personales presentaba enfermedad pulmonar obstructiva crónica (EPOC) con alto riesgo de reagudizaciones, hipertensión arterial, hipoacusia neurosensorial, osteoporosis, insomnio, hiperlipemia, depresión, cefalea tensional e insuficiencia renal. El tratamiento domiciliario que seguía era calcifediol, lormetazepam, ivabradina, carbonato cálcico, atorvastatina, citalopram, manidipino, omeprazol, montelukast, budesonida, formoterol, paracetamol y metamizol. La paciente presentaba un cuadro clínico progresivo de 3 años de duración, caracterizado por un dolor similar a una descarga de corriente eléctrica en el pie derecho, que se irradiaba desde el lado interno del tobillo a nivel retromaleolar por toda la planta del pie hasta el dedo gordo. El dolor aumentaba progresivamente con la marcha hasta hacerse insoportable, obligando a la paciente a detenerse y colocarse en posición de decúbito con el pie algo elevado o a sentarse sin apoyarlo. En esta postura, el dolor iba cediendo después de algún tiempo. Cualquier contacto sobre la región posterior al maléolo interno provocaba una fuerte descarga dolorosa extendida hacia todos los dedos, por lo que desde hacía 2 meses la paciente solo podía vestir una zapatilla sin talonera en ese pie. Dicho dolor lo relacionaba con un traumatismo previo sucedido 3 años antes en la zona retromaleolar con una silla. Nuestra paciente era remitida desde atención primaria con el diagnóstico de “ciática atípica”.
Exploración física
La exploración clínica mostraba un tobillo derecho de aspecto completamente normal, con ligera inflamación aparente en la región retromaleolar interna. Las maniobras de elongación del nervio ciático y de sus raíces espinales eran indoloras. No se apreciaba ningún déficit neurológico radicular. La palpación del trayecto del NTP desde unos centímetros por encima del maléolo interno provocaba un dolor muy intenso, irradiado hacia la planta del pie y a todos los dedos, sobre todo a los 2 primeros. Durante la palpación se llegó a localizar una pequeña masa de consistencia dura en la región retromaleolar. A la percusión de esta (Tinnel), la paciente presenta dolor muy intenso y parestesias que se irradiaban a dedos. La severidad del dolor provocado por el simple contacto era tal que la paciente se negaba rotundamente a ser reexplorada o manipulada, mostrando un intenso temor a cualquier contacto sobre la zona del maléolo interno. No se apreció trastorno de la sensibilidad en la planta del pie y en los dedos.
Pruebas complementarias
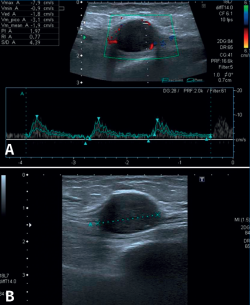
Una reciente analítica convencional de sangre y orina fue normal. Las radiografías del tobillo, aportadas también por la enferma, eran normales. Con el diagnóstico de sospecha de STT por algún tipo de masa se decide la realización de una ecografía del tobillo derecho. El informe del radiólogo informó de una lesión hipoecoica y homogénea, sólida y moderadamente vascularizada (predominantemente en la zona periférica) de aproximadamente 2 × 1,8 cm en el eje transversal y longitudinal. La lesión depende del NTP al nivel del túnel del tarso, siendo dolorosa a la palpación ecográfica. Las imágenes representativas de este estudio las podemos ver en la Figura 1.
rpt.3602.fs2206012-figura1.png
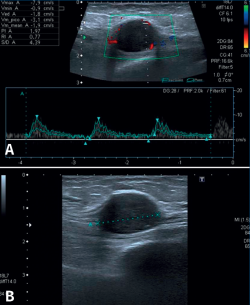
Figura 1. Ecografía de tobillo. A: vista de eje largo del nervio tibial posterior que muestra masa de partes blandas con vascularización en la ecografía Doppler color; B: imagen que muestra el tumor del nervio tibial posterior como una masa de tejido blando hipoecoico, con refuerzo posterior dentro de la vaina del nervio.
Para confirmar el diagnóstico, se realizaron una electromiografía del miembro inferior derecho, con resultados dentro de la normalidad, y una resonancia magnética (RM) de tobillo como podemos ver en la Figura 2.
rpt.3602.fs2206012-figura2.png
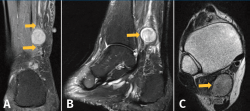
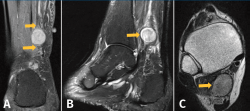
Figura 2. Resonancia magnética (RM) del tobillo derecho. A: imagen de masa en el plano coronal del tobillo potenciada en T2 con clásico aumento de señal de la lesión neurógena, donde se muestra lesión con su rama aferente y eferente dependiente del nervio tibial posterior; B: imagen sagital potenciada en T2. La flecha indica un aumento de la intensidad de la señal de manera heterogénea en la periferia de la masa de tejido blando y una disminución de la intensidad de la señal en el centro de la masa (signo de la diana); C: imagen de corte transversal de RM ponderada en T1 que muestra una masa homogénea de baja intensidad retromaleolar.
El radiólogo informó esta como lesión nodular hiperintensa homogénea en T2 e isointensa en T1 de 19 × 15 × 14 mm de tamaño al nivel del tercio medio de la grasa de Kager y posterior y medial al músculo flexor largo del hallux. Presenta continuidad con una estructura tubular en su polo superior e inferior muy posiblemente nerviosa y compatible con el diagnóstico de tumor neuronal de la vaina nerviosa del NTP. También se aprecia un discreto derrame en la articulación del tobillo y un proceso de Steida moderadamente prominente.
En nuestro caso no realizamos biopsia prequirúrgica de la lesión y con el diagnóstico de tumor de la vaina nerviosa del tibial posterior propusimos a la paciente para tratamiento quirúrgico.
Tratamiento
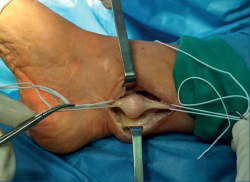
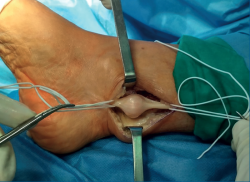
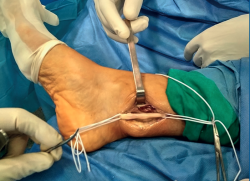
A los 2 meses, bajo anestesia raquídea, profilaxis antibiótica con 1 g de cefazolina y con manguito de isquemia en la raíz del muslo con una presión de 300 mmHg, se practicó una incisión ligeramente en J, a 15 mm por detrás del maléolo interno, de unos 4 cm de longitud desde proximal a distal. Inmediatamente bajo la piel apareció el tejido celular subcutáneo y la fascia superficial. Se apreció un engrosamiento tisular que, al ser expuesto, se mostró como un tumor alojado sobre el NTP, por encima de su entrada en el ligamento anular del túnel tarsiano. Se disecó el fascículo nervioso proximal y distal del tumor, y se referenció como se muestra en la Figura 3.
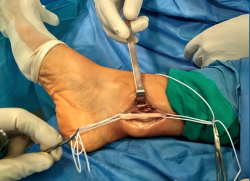
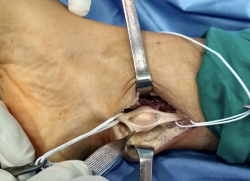
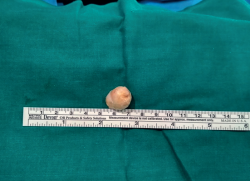
Con el uso de gafas lupas de 3,5 aumentos, se incidió el epineuro del nervio (Figura 4), apareciendo un tumor esférico de 19 mm de diámetro (Figura 5), dependiente de la vaina del NTP, y se extirpó este en bloque junto con el fascículo de origen, pero conservando la integridad del resto de los fascículos del tronco nervioso, que se encontraban muy aplanados.
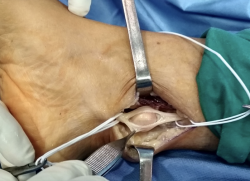
Posteriormente, se volvió a cerrar en epineuro con sutura de puntos simples con monofilamento de 6/0, restaurando la integridad del nervio como se puede ver en la Figura 6.
Para finalizar, se realizó hemostasia cuidadosa con bipolar, lavado abundante con suero fisiológico, cierre por planos y tejido celular subcutáneo con Novosyn® poliglactina de 3/0 y puntos simples de monofilamento no absorbible sobre la piel de 3/0. Se cubrió con apósitos estériles y povidona yodada en crema, junto con un vendaje compresivo suropédico durante varios días. Las curas de la herida quirúrgica se las realizaron en su centro de salud cada 48 horas con povidona yodada líquida y los puntos practicados sobre la piel le fueron retirados a los 15 días, apreciando una curación excelente de la herida quirúrgica. El resto del postoperatorio cursó sin incidentes, controlando el dolor de la herida con medicación analgésica del primer escalón de la Organización Mundial de la Salud (OMS). No se objetivó ningún déficit sensorial como secuela. El dolor neuropático desapareció de inmediato y la paciente se ha mantenido asintomática durante 4 años, hasta la última revisión realizada telefónicamente en enero de 2021.
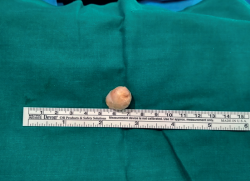
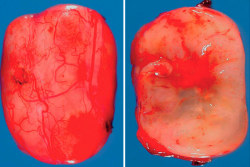
El diagnóstico de certeza nos lo evidenció el estudio anatomopatológico de la lesión. En el estudio macroscópico, se observó (Figura 7) una masa bien definida y encapsulada, de color grisáceo-blanquecino, con vasos epineurales en su región más externa, que se introducían hasta el interior de la masa.
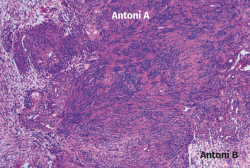
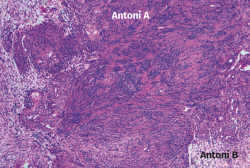
En el estudio histológico que le fue realizado a la tumoración extirpada, el informe describió histológicamente áreas celulares (Antoni A) y áreas hipocelulares (Antoni B), con alto contenido mixoide (Figura 8). Además, no se observaron mitosis ni necrosis, pero sí áreas hialinizadas, pseudoquísticas y con zonas de macrófagos compatibles con alteraciones degenerativas (schwannoma evolucionado).
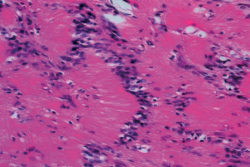
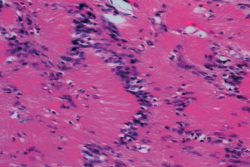
Al ampliar la imagen histológica, dentro de las zonas Antoni A, se pudieron observar células cuyos núcleos se disponen en empalizada formando los denominados cuerpos de Verocay, como nos muestra la Figura 9, siendo estos típicos pero no exclusivos de los schwannomas. En el estudio inmunohistoquímico que se le realizó obtuvimos los siguientes resultados: vimentina+, S-100+, CK (AE1/AE3−), CD45−, EMA− y Ki67 < 5%.
Discusión
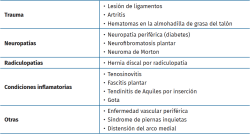
Los pacientes con dolor neuropático en los miembros inferiores deben ser estudiados de manera exhaustiva, ya que con frecuencia su diagnóstico etiológico se puede retrasar porque existen multitud de causas que provocan una sintomatología similar, atribuyéndose normalmente a neuropatía por atrapamiento o a radiculopatía lumbosacra. Existen estudios que ponen de manifiesto que una de las más extrañas causas de los dolores neuropáticos en los miembros inferiores, por su baja frecuencia (1%), es el schwannoma del NTP, ya que estos se localizan en la cabeza, el cuello y el miembro superior con más frecuencia(10). Estos tumores son los más comunes de la vaina de los nervios periféricos, suelen aparecer entre la tercera y la quinta década de la vida, sin diferencias raciales ni de género(20). La etiología de los schwannomas es desconocida, pero Rosalie E. Ferner(11) reporta que una de las causas que los pueden provocar y con la que existe relación son los traumatismos y la neurofibromatomatosis de tipo 2. En el caso de nuestra paciente, el único antecedente que nos cuenta es un traumatismo previo 3 años antes, con lo cual apoyamos esta teoría, aunque no podemos justificarlo de manera fehaciente. Cuando las células de Schwann crecen de manera anormal en el NTP a su paso por el túnel tarsiano, pueden causar compresión y desplazamiento de importantes fascículos nerviosos. Esto puede resultar en dolor a la palpación y entumecimiento, afectando tanto al NTP como a sus ramificaciones, que se pueden comprimir dentro del túnel dando como resultado STT. El STT a menudo se diagnostica erróneamente porque el dolor y la proximidad imitan diversas afecciones que provocan un diagnóstico tardío. Tladi et al. publican en su trabajo una serie de patologías que pueden retrasar el diagnóstico de STT y pueden verse en la Tabla 1(8).
Como podemos comprobar, este retraso del diagnóstico se confirma con el caso clínico que nosotros presentamos, donde la sintomatología se evidencia entre en los 82 y los 85 años, 3 años antes del diagnóstico, aunque, dado que se trata de un tumor de crecimiento muy lento, pensamos que la neoplasia se podría haber producido mucho antes, pero era asintomática. Esto concuerda con la bibliografía encontrada, como es el caso de Nawabi et al., que comunicaron 25 casos de schwannoma de NTP con una duración media de los síntomas antes del diagnóstico de 86,5 meses (7 años)(21).
Para elaborar un diagnóstico clínico de SST, se debe obtener una historia típica y el examen físico debe incluir pruebas de provocación positivas, como la prueba de Tinnel, como presentaba nuestra paciente, o reproducir la clínica con la de dorsiflexión del pie. Estas pruebas llevarán a provocar dolor y parestesias en el territorio nervioso afectado, pero debemos tener en cuenta que pueden variar en sensibilidad y especificidad según el grado de compresión (estadio de la enfermedad) del nervio: a mayor compresión, la clínica se hace más frecuente y reproducible(22). Cuando pensemos en el schwannoma como causa de STT, debemos buscar en la exploración física, además de la clínica ya comentada, cierta deformidad en la piel o alguna masa palpable, puesto que la clínica neurológica aparece posteriormente, como dicen en su trabajo Boya et al.(18) y nosotros observamos en nuestra corta experiencia.
Una vez tenemos el diagnóstico de presunción, debemos apoyarnos en pruebas de imagen para llegar el diagnóstico de certeza. Nosotros pensamos que el algoritmo que debemos seguir es el siguiente. En primer lugar, solicitar una radiografía simple de tobillo para descartar cualquier afectación o anomalía ósea. Dado que nos encontramos ante un paciente con clínica de atrapamiento compresivo nervioso, pensamos que es muy costo-eficiente realizar una prueba de ultrasonido musculoesquelética que nos informe grosso modo de la causa que está provocando la dolencia de nuestro enfermo. La ecografía mostrará típicamente una masa homogénea hipoecoica, ovoide, sólida, vascularizada en su periferia y delineada con precisión en la periferia del nervio(23,24) que, en manos de un ecografista experimentado, prácticamente nos daría el diagnóstico.
Reconocemos que la RM es el patrón oro para identificar estos tumores dentro del NTP y diferenciar entre schwannoma, neurofibroma y otros tumores de los tejidos blandos. Un schwannoma se origina y crece en la periferia del nervio, provocando compresión y desplazamiento lateral o medial del nervio. Por el contrario, los neurofibromas se originan dentro del tejido neural, con fibras nerviosas atrapadas dentro del tumor. El tumor suele aparecer hipointenso en las secuencias potenciadas en T1 e hiperintenso en las secuencias potenciadas en T2, aunque el patrón característico del schwannoma en RM es el llamado signo de la diana, que se observa en las imágenes ponderadas en T2. Varma(25) observa este signo en el 52% de los casos de su trabajo, al igual que nosotros lo hemos identificado en nuestra paciente (Figura 2), y consiste en un borde hiperintenso y un núcleo hipointenso, que corresponden histológicamente al tejido mixomatoso periférico y al tejido fibrocolágeno central, respectivamente.
La RM también ayuda a localizar y determinar el tamaño de la masa y la extensión de la infiltración nerviosa por el tumor, algo crucial para la planificación preoperatoria, pero desgraciadamente no nos permite diferenciar entre si es un schwannoma benigno o maligno, por lo que la única manera de saberlo de manera objetiva es practicando una biopsia ecoguiada del tumor. Esto se puede realizar de manera preoperatoria, ya que como comentábamos en la introducción este tipo de tumores presentan una cápsula fibrosa que evita la diseminación de células malignas, como informan trabajos ya publicados(26). Con respecto a la biopsia de estas lesiones, debemos tener presente que puede ser bastante dolorosa y los pacientes deben estar debidamente informados. En la práctica diaria, y nosotros así lo hicimos, no se requiere una biopsia si las apariencias radiológicas son típicas de un pequeño tumor benigno de la vaina nerviosa y este es estudiado después de la extirpación. Sin embargo, los tumores mayores de 5 cm, las lesiones heterogéneas y las lesiones de rápido crecimiento justifican una biopsia ayudada por pruebas de imagen para confirmar el diagnóstico.
Otra de las pruebas clásicas en la que podemos pensar para solicitar a nuestros pacientes con clínica de compresión nerviosa es la famosa electromiografía. Como sabemos, en el STT la velocidad de conducción nerviosa enlentecida nos puede ayudar al diagnóstico, pero de ninguna manera su resultado es definitorio, como ya anunciaba Viladot(6). Pues bien, lo mismo ocurre en el caso del schwannoma, ya que Aydin(27) en su trabajo concluye que un schwannoma generalmente no interfiere con la función nerviosa, por lo que las velocidades de conducción retardadas no son específicas para esta lesión.
Los análisis histológicos y patológicos demostrarán que los schwannomas son masas fusiformes de tamaño variable y que tienen verdaderas cápsulas compuestas de epineuro (Figura 7)(8,19). La evaluación microscópica muestra que los schwannomas constan de 2 tejidos distintivos, la región de Antoni A, que es densamente celular y ordenada en haces cortos o fascículos entrelazados (cuerpos de Verocay), y la región de Antoni B, que tiene menos células y áreas desorganizadas con un mayor componente mixoide dispuestas en un estroma suelto como mostramos en las Figuras 8 y 9(9,14,19,21,28). Hao et al.(19) nos informan en su estudio, además, que cuando en la histología nos encontramos zonas de proliferación de células fusiformes concéntricas alrededor de los vasos sanguíneos con haces irregulares junto con áreas de necrosis, anaplasia y mitosis excesiva, debemos pensar en malignidad (neurofibrosarcoma), aspectos que no fueron encontrados en nuestra masa. Con respecto a la inmunohistoquímica, los schwannomas suelen mostrar una expresión fuerte y difusa de la proteína S100(29,30,31). Folpe y Gown han declarado que la inmunotinción de la proteína S100 y vimentina identifica sistemáticamente los schwannomas y que sirve como una importante herramienta de diagnóstico debido a la fuerza de su expresión(9). En el caso de nuestra paciente ambas fueron positivas y se observó abundante colágeno de tipo IV pericelular(32). Además, presentó un Ki-67 < 5%, por lo que el marcador de proliferación celular era de benignidad. Por tanto, la clínica, junto con los estudios de imagen y el estudio anatomopatológico, permitieron objetivamente diagnosticar a nuestra paciente de schwannoma benigno dependiente del NTP.
Con respecto al tratamiento, la exéresis quirúrgica de la masa y la descompresión del NTP son los tratamientos recomendados, especialmente cuando hay dolor neuropático, tanto para disminuir la sintomatología como para obtener confirmación histológica y excluir malignidad, pero son varios los aspectos clave que advertimos que deben ser tenidos en cuenta durante la técnica quirúrgica.
El primero y más importante es informar adecuadamente al paciente de los riesgos y beneficios que supondrá la cirugía en su calidad de vida. Los riesgos derivados de la cirugía se muestran en la Tabla 2. Nuestra paciente analizó las opciones de tratamiento y sintió que los síntomas habían mermado enormemente su día a día. Se le informó de los riesgos quirúrgicos que asumía y se decidió por el tratamiento quirúrgico.
Con respecto al tratamiento anestésico que debe tener el paciente en el momento quirúrgico, pensamos que debe ser valorado por parte de un anestesiólogo y que principalmente dependerá de la localización del tumor y de la comorbilidad del paciente. En la bibliografía revisada no hemos encontrado diferencias entre la anestesia general con respecto a la troncular. En nuestra opinión, este tipo de cirugías nunca deben ser realizadas únicamente con bloqueo anestésico local del tejido circundante y sedación, por lo que recomendamos bloqueo troncular o anestesia general. Debemos tener muy claro que, aunque la tasa de recurrencia es inferior al 5%, una vez aceptada la cirugía por parte del paciente se recomienda la resección completa. Durante esta, la preservación del fascículo motor y sensitivo es la clave(33) para prevenir complicaciones neurológicas.
Es fundamental exponer el nervio afectado con márgenes suficientes, tanto proximal como distalmente a la lesión. Una exposición adecuada permitirá una visualización adecuada de la anatomía y también facilitará la disección sin obstrucciones del tumor del nervio principal. Una manera adecuada de poder observar el campo quirúrgico y la anatomía es realizar la intervención con un manguito de isquemia en la raíz del muslo de la pierna que se va a intervenir con una presión máxima de 300 mmHg(34). También la posibilidad de resecar estos tumores con el uso de microscopios quirúrgicos reduce la posibilidad de lesión de fascículos motores o sensitivos y una mejor visualización de la anatomía, evitando de esta manera consecuencias negativas posquirúrgicas, pero entendemos que no en todos los hospitales existen estos recursos, por lo que aconsejamos que se realice la intervención como mínimo con gafas de aumento, al igual que la realizamos nosotros. Para reducir otra complicación como es la infección de la herida quirúrgica, debemos utilizar profilaxis antibiótica dependiendo de las resistencias de cada hospital, antes de realizar la isquemia y la administración debe ser justo en el momento perioperatorio (media hora antes de realizar la incisión de la piel)(35).
Un reciente estudio de Kellner et al.(36) realiza este tipo de cirugías con estimulación nerviosa intraoperatoria y monitorización neurofisiológica. Justifican este procedimiento por 2 motivos principalmente. El primero es porque permite la confirmación de la anatomía visualizada. El segundo motivo es porque la estimulación nerviosa intraoperatoria es fundamental para identificar la ubicación óptima para realizar la incisión en la lesión y la neurólisis interna, ya que permite diferenciar el tejido conductor del no conductor. A partir de los resultados de las pruebas neurofisiológicas, se puede seleccionar un área inactiva de fibras nerviosas y realizar una incisión longitudinal a lo largo de la dirección de las fibras epineurales para minimizar la alteración de la integridad anatómica y la funcionalidad del nervio principal. Esto mejora lo publicado por Kwok(24) que en su artículo informa que la incisión realizada de manera longitudinal en la porción media del tumor a nivel del epineuro es menos invasiva para el nervio.
Otros pequeños trucos que nos reporta Miranpuri(37) son una vez extirpado el tumor lavar la herida con abundantes cantidades de solución salina estéril con el fin de evitar la infección y la inyección periincisional de un centímetro cúbico de fosfato de dexametasona, asegurándose de evitar la inyección en el sistema venoso, buscando un efecto antiinflamatorio y analgésico.
Conclusiones
A pesar de sufrir durante 3 años el STT secundario a un schwannoma de la vaina del NTP, esta paciente evolucionó favorablemente después de la cirugía de extirpación de este schwannoma solitario. La disección meticulosa es el punto más importante para reducir las complicaciones postoperatorias y reducir el riesgo de recurrencia, ya que, como se ha demostrado, los neurinomas pueden extirparse sin sacrificar el nervio en el que asientan, lo que supone la curación sin secuelas. Por supuesto, debemos tener en cuenta que, cuanto más precoz sea la intervención quirúrgica, mejores resultados se obtendrán. Los nuevos métodos de monitorización y estimulación intraquirúrgica pueden ayudarnos en el momento de la intervención y evitar complicaciones futuras.
Este caso se ha presentado para proporcionar información sobre cómo diagnosticar, investigar y tratar dichos casos. Las limitaciones de este trabajo son la falta de información electrofisiológica y el corto periodo de seguimiento. Aunque el schwannoma del NTP que causa el síndrome del túnel del tarso es raro, debe considerarse ante cualquier tumoración.
Figuras
Figura 1. Ecografía de tobillo. A: vista de eje largo del nervio tibial posterior que muestra masa de partes blandas con vascularización en la ecografía Doppler color; B: imagen que muestra el tumor del nervio tibial posterior como una masa de tejido blando hipoecoico, con refuerzo posterior dentro de la vaina del nervio.
Figura 2. Resonancia magnética (RM) del tobillo derecho. A: imagen de masa en el plano coronal del tobillo potenciada en T2 con clásico aumento de señal de la lesión neurógena, donde se muestra lesión con su rama aferente y eferente dependiente del nervio tibial posterior; B: imagen sagital potenciada en T2. La flecha indica un aumento de la intensidad de la señal de manera heterogénea en la periferia de la masa de tejido blando y una disminución de la intensidad de la señal en el centro de la masa (signo de la diana); C: imagen de corte transversal de RM ponderada en T1 que muestra una masa homogénea de baja intensidad retromaleolar.
Figura 3. Imagen intraquirúrgica donde se muestra una masa sólida, dependiente del nervio tibial posterior, referenciando el fascículo nervioso aferente a la derecha y el fascículo nervioso eferente a la izquierda.
Figura 6. Nervio tibial posterior con sutura del epineuro, donde se puede observar la integridad de este.
Figura 7. Visión macroscópica a gran aumento del schwannoma extirpado seccionado con un corte sagital.
Figura 8. Microfotografía realizada con tinción de hematoxilina y eosina, donde se muestran áreas Antoni A con tejido fibrilar, intensamente polar y de apariencia alargada, y áreas Antoni B constituidas por regiones microquísticas sueltas, distintas y adyacentes a las regiones de Antoni A.
Figura 9. Microfotografía realizada con tinción de hematoxilina y eosina, donde, al ampliar una zona Antoni A, observamos un área de alta celularidad y células fusiformes con núcleos alineados formando una empalizada nuclear (cuerpos de Verocay).
Tablas
Información del artículo
Cita bibliográfica
Autores
José Luis Jiménez Blázquez
Complejo Hospitalario de Jaén. Hospital Neurotraumatológico. Jaén
Manuel García Carmona
Hospital Universitario Reina Sofía. Córdoba
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación. Los autores declaran que este trabajo no ha sido financiado.
Conflicto de intereses. Los autores declaran no tener ningún conflicto de intereses.
Referencias bibliográficas
-
1Latarjet M. Anatomía humana. 2.ª ed. México D. F.: Editorial Médica Panamericana; 1989.
-
2Kopell HP, Thompson WA. Peripheral entrapment neuropathies of the lower extremity. N Engl J Med. 1960 Aug 14;262:56-60.
-
3Janecki CJ, Dovberg JL. Tarsal-tunnel syndrome caused by neurilemmoma of the medial plantar nerve. A case report. J Bone Joint Surg Am. 1977 Jan;59(1):127-8.
-
4Doneddu PE, Coraci D, Loreti C, Piccinini G, Padua L. Tarsal tunnel syndrome: still more opinions than evidence. Status of the art. Neurol Sci. 2017 Oct;38(10):1735-9.
-
5Dellon AL, Mackinnon SE. Tibial nerve branching in the tarsal tunnel. Arch Neurol. 1984 Jun;41(6):645-6.
-
6Viladot Pericé A. Quince lecciones sobre patología del pie. 2.ª ed. Barcelona, Nueva York: Springer; 2000.
-
7Watanabe K, Fukuzawa T, Mitsui K. Tarsal Tunnel Syndrome Caused by a Schwannoma of the Posterior Tibial Nerve. Acta Med Okayama. 2018 Feb;72(1):77-80.
-
8Tladi MJ, Saragas NP, Ferrao PN, Strydom A. Schwannoma and neurofibroma of the posterior tibial nerve presenting as tarsal tunnel syndrome: review of the literature with two case reports. Foot (Edinb). 2017 Aug;32:22-6.
-
9Milnes HL, Pavier JC. Schwannoma of the tibial nerve sheath as a cause of tarsal tunnel syndrome--a case study. Foot (Edinb). 2012 Sep;22(3):243-6.
-
10Abdel Razek AAK, Gamaleldin OA, Elsebaie NA. Peripheral Nerve Sheath Tumors of Head and Neck: Imaging-Based Review of World Health Organization Classification. J Comput Assist Tomogr. 2020 Nov/Dec;44(6):928-40.
-
11Ferner RE, O'Doherty MJ. Neurofibroma and schwannoma. Curr Opin Neurol. 2002 Dec;15(6):679-84.
-
12Schweitzer KM Jr, Adams SB Jr, Nunley JA 2nd. Multiple schwannomas of the posterior tibial nerve: a case series. Foot Ankle Int. 2013 Apr;34(4):607-11.
-
13Salar M, Kaye MB. Multiple Schwannomas of the Median Nerve: A Case Report and Review of the Literature. J Orthop Case Rep. 2020 Sep;10(6):60-3.
-
14Yonezawa H, Miwa S, Yamamoto N, Hayashi K, Takeuchi A, Igarashi K, et al. Structural Origin and Surgical Complications of Peripheral Schwannomas. Anticancer Res. 2020 Nov;40(11):6563-70.
-
15Carvajal JA, Cuartas E, Qadir R, Levi AD, Temple HT. Peripheral nerve sheath tumors of the foot and ankle. Foot Ankle Int. 2011 Feb;32(2):163-7.
-
16Kehoe NJ, Reid RP, Semple JC. Solitary benign peripheral-nerve tumours. Review of 32 years' experience. J Bone Joint Surg Br. 1995 May;77(3):497-500.
-
17Hallahan K, Vinokur J, Demski S, Faulkner-Jones B, Giurini J. Tarsal tunnel syndrome secondary to schwannoma of the posterior tibial nerve. J Foot Ankle Surg. 2014 Jan-Feb;53(1):79-82.
-
18Boya H, Ozcan O, Oztekin HH. Tarsal tunnel syndrome associated with a neurilemoma in posterior tibial nerve: a case report. Foot (Edinb). 2008 Sep;18(3):174-7.
-
19Hao X, Levine D, Yim J, Qi C, Firestone L, Beiser I, et al. Schwannoma of Foot and Ankle: Seven Case Reports and Literature Review. Anticancer Res. 2019 Sep;39(9):5185-94.
-
20Pilavaki M, Chourmouzi D, Kiziridou A, Skordalaki A, Zarampoukas T, Drevelengas A. Imaging of peripheral nerve sheath tumors with pathologic correlation: pictorial review. Eur J Radiol. 2004 Dec;52(3):229-39.
-
21Nawabi DH, Sinisi M. Schwannoma of the posterior tibial nerve: the problem of delay in diagnosis. J Bone Joint Surg Br. 2007 Jun;89(6):814-6.
-
22Patel AT, Gaines K, Malamut R, Park TA, Toro DR, Holland N; American Association of Neuromuscular and Electrodiagnostic Medicine. Usefulness of electrodiagnostic techniques in the evaluation of suspected tarsal tunnel syndrome: an evidence-based review. Muscle Nerve. 2005 Aug;32(2):236-40.
-
23Jack CM, Jones G, Edwards MR, Singh SK. A case report of three peripheral schwannomas attached to the Achilles paratenon. Foot (Edinb). 2010 Jun-Sep;20(2-3):78-80.
-
24Kwok KB, Lui TH, Lo WN. Neurilemmoma of the first branch of the lateral plantar nerve causing tarsal tunnel syndrome. Foot Ankle Spec. 2009 Dec;2(6):287-90.
-
25Varma DG, Moulopoulos A, Sara AS, Leeds N, Kumar R, Kim EE, Wallace S. MR imaging of extracranial nerve sheath tumors. J Comput Assist Tomogr. 1992 May-Jun;16(3):448-53.
-
26Carter J, Ben-Ghashir N, Chandrasekar CR. Giant schwannoma of the medial plantar nerve. Foot (Edinb). 2016 Mar;26:4-6.
-
27Aydin AT, Karaveli S, Tuzuner S. Tarsal tunnel syndrome secondary to neurilemoma of the medial plantar nerve. J Foot Surg. 1991 Mar-Apr;30(2):114-6.
-
28Jha AJ, Basetty CR, Viner GC, Tedder C, Shah A. Posterior Tibial Nerve Schwannoma Presenting as Tarsal Tunnel Syndrome. Cureus. 2019 Aug 1;11(8):e5303.
-
29Ogose A, Hotta T, Morita T, Yamamura S, Hosaka N, Kobayashi H, Hirata Y. Tumors of peripheral nerves: correlation of symptoms, clinical signs, imaging features, and histologic diagnosis. Skeletal Radiol. 1999 Apr;28(4):183-8.
-
30Stefansson K, Wollmann R, Jerkovic M. S-100 protein in soft-tissue tumors derived from Schwann cells and melanocytes. Am J Pathol. 1982 Feb;106(2):261-8.
-
31Henderson DW, Papadimitriou JM, Coleman M. Ultrastructural appearances of tumours: diagnosis and classification of human neoplasia by electron microscopy. 2nd ed. Edinburgh: Churchill Livingstone; 1986.
-
32Rodríguez FJ, Folpe AL, Giannini C, Perry A. Pathology of peripheral nerve sheath tumors: diagnostic overview and update on selected diagnostic problems. Acta Neuropathol. 2012 Mar;123(3):295-319.
-
33Woodruff JM, Selig AM, Crowley K, Allen PW. Schwannoma (neurilemoma) with malignant transformation. A rare, distinctive peripheral nerve tumor. Am J Surg Pathol. 1994 Sep;18(9):882-95.
-
34Date R, Muramatsu K, Ihara K, Taguchi T. Advantages of intra-capsular micro-enucleation of schwannoma arising from extremities. Acta Neurochir (Wien). 2012 Jan;154(1):173-8; discussion 178.
-
35Minola E, Farina C, Zappone C, Arosio M, Lorenzi N, Mazzoni A. Short-term antibiotic prophylaxis for the prevention of wound infection and secondary meningitis in acoustic neuroma surgery: a ten-year experience in a regional hospital. J Chemother. 2000 Dec;12(6):521-4.
-
36Kellner CP, Sussman E, Bar-David T, Winfree CJ. Schwannomas of the foot and ankle: a technical report. J Foot Ankle Surg. 2014 Jul-Aug;53(4):505-10.
-
37Miranpuri S, Snook E, Vang D, Yong RM, Chagares WE. Neurilemoma of the posterior tibial nerve and tarsal tunnel syndrome. J Am Podiatr Med Assoc. 2007 Mar-Apr;97(2):148-50.
Descargar artículo:
Licencia:
Este contenido es de acceso abierto (Open-Access) y se ha distribuido bajo los términos de la licencia Creative Commons CC BY-NC-ND (Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional) que permite usar, distribuir y reproducir en cualquier medio siempre que se citen a los autores y no se utilice para fines comerciales ni para hacer obras derivadas.
Comparte este contenido
En esta edición
- Editorial de la presidenta
- Coaliciones tarsales, opciones terapéuticas y abordaje artroscópico
- Reducción cerrada y fijación percutánea con agujas de la fractura-luxación de Lisfranc
- Infección en reconstrucción del tendón de Aquiles. Cirugía de rescate mediante aloinjerto aquíleo
- Resultados del tratamiento del pie plano del adulto estadio IIB mediante doble osteotomía del calcáneo
- Clavo tibiotalocalcáneo en el tratamiento de fracturas osteoporóticas inestables: revisión de casos
- Schwannoma, una extraña causa de síndrome del túnel del tarso
- Fracturas y luxaciones de Chopart: nuestro algoritmo de tratamiento
- Luxación peritalar medial abierta: a propósito de un caso
- Angioma cavernoso del astrágalo y reconstrucción con técnica de membrana inducida. Reporte de un caso y revisión de la literatura
- Revista de revistas
Más en PUBMED
Más en Google Scholar


Revista del pie y tobillo está distribuida bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.